Промышленности
1 Культивируемые клетки растений сохраняют присущую исходному виду растения способность синтезировать широкий спектр веществ вторичного метаболизма: алкалоида, терпеноиды, гликозиды, полифенолы, полисахариды, эфирные масла, необычные пептиды и специализированные белки, натуральные красители, стероиды, пряности, инсектициды, воски, витамины. В растениях содержится огромное разнообразие веществ вторичного происхождения. Несмотря на такое название, они играют важную роль в обмене веществ растений. Многие из них широко используются в медицине и технике, пищевой и парфюмерной промышленности, сельском хозяйстве.
Первыми среди вторичных веществ в культуре ткани привлекли внимание исследователей алкалоиды. Анализ каллусных культур барвинка розового, раувольфии змеиной, белены черной, дурмана и др. показал, что они содержат алкалоиды. Благодаря усилиям многих ученых накоплено немало ценной информации о способности каллусных тканей синтезировать другие биологически активные вещества.
Промышленное выращивание клеток и тканей – продуцентов экономически важных веществ – новое направление биотехнологии. Если традиционные биотехнологии для получения ценных биологически активных веществ использовали целые организмы: микроорганизмы, растения, животных, то современная биотехнология нацелена на клеточные технологии, основанные на культивировании свободных и иммобилизованных клеток. Рассмотрим три аспекта применения культуры клеток растений в биосинтетической промышленности.
Доказана возможность культуры клеток осуществлять биотрансформацию, то есть синтезировать некоторые биологические активные вещества из дешевых и доступных их предшественников. Эти «полупродукты » вторичных веществ не могут быть преобразованы химическим или микробиологическим путем, и только благодаря ферментам клеток в культуре происходит их химическое превращение в ценный конечный продукт. Изменение состава питательной среды и других параметров культивирования приводит к изменению не только количественного, но и качественного состава продуктов биосинтеза, в результате чего могут быть получены совершенно новые соединения с принципиально другим типом действия. Японские исследователи добились успехов в получении in vitro таких новых биологически активных веществ, как необычные пептиды, антиканцерогенные соединения, убихинон-10 и др. Следующим шагом в клеточной биотехнологии станет использование иммобилизованных растительных клеток. Культура клеток, для того, чтобы стать объектом промышленного выращивания, должна выдержать конкуренцию с дикорастущими и культурными лекарственными, техническими растениями, а также с микробиологическим производством и химическим синтезом. По сравнению с традиционным растительным сырьем клеточные культуры обладают следующими преимуществами: 1) независимость от влияния различных факторов окружающей среды (климат, сезон, погода, почвенные условия, вредители); 2) более высокий выход и качество продукта благодаря оптимизации и стандартизации условий выращивания; 3) экономия посевных площадей.
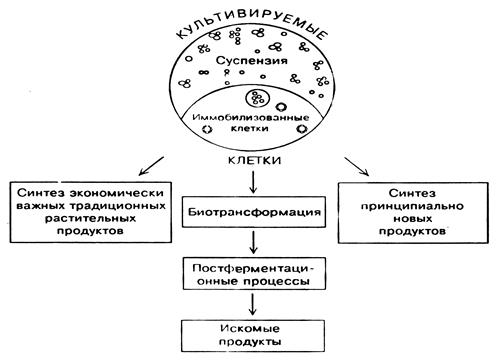
Рисунок 8. Пути получения важных продуктов с использованием
культивируемых клеток растений
Учитывая, что только растения являются источником многих экономически важных веществ, а запасы растительного сырья в природе истощаются, нетрудно представить место клеточных технологий в будущем. Переход от научных разработок к промышленному получению продуктов с использованием клеточных культур только начинается. Ограничением в создании высокорентабельных технологий является недостаточность фундаментальных знаний о генетической, биохимической, физиологической регуляции вторичного метаболизма в растительной клетке.
Возможные функции вторичных веществ в интактном растении до конца не изучены, но для большинства из них основной функцией является защита растений от различных стрессовых факторов, то есть они играют регуляторную роль, обеспечивая жизнедеятельность организма.
Клетки in vitro – это новая, экспериментально созданная биологическая система, особенности которой, в том числе и функции вторичных соединений, еще мало изучены. Показано, что иногда у культивируемых клеток в специализированном обмене проявляются особенности, характерные для филогенетически ранних групп растений или ювенильной стадии развития растения. Недостаток фундаментальных знаний очень тормозит развитие технологии культивируемых клеток. Популяция клеток in vitro проходит определенный онтогенез: размножение (деление) – растяжение – дифференцировка – старение – смерть клеток. Соотношение клеток, находящихся на разных стадиях развития, меняется в зависимости от того, какой процесс преобладает. При изменении условий культивирования равновесие смещается в ту или иную сторону. Дифференцировка каллусной клетки, вышедшей из цикла деления, заключается в ее специализации на синтезе видоспецифичных вторичных соединений. Данные о контроле биосинтеза вторичных метаболитов клеточной дифференциацией неоднозначны. Если в ряде случаев синтез вторичных веществ на- чинается с появлением в культуре морфогенных структур, то в других опытах высокий выход искомых веществ наблюдался в недифференцированной каллусной ткани.
Также противоречивы и сообщения о взаимосвязи синтеза вторичных соединений с ростом клеток. У многих культур при периодическом режиме выращивания вторичные метаболиты накапливаются в значительных количествах лишь при замедлении или остановке роста, хотя в отдельных случаях синтез продукта способствует росту клеток. Возможно, механизмы и условия, блокирующие деление клеток и активный рост, являются одновременно механизмами активации, обеспечивающими синтез ферментов вторичного метаболизма.
В любом случае прежде всего стараются создать оптимальные условия для роста, то есть накопления биомассы, а затем исследуют влияние этих условий на биосинтез вторичных метаболитов. Если образование биомассы не связано с синтезом вторичного вещества, стараются установить баланс между биомассой и выходом вещества.
2.1 Генотип родительского растения, то есть донора экспланта для введения в культуру, существенно влияет на биосинтетический потенциал культивируемых клеток. М.Ценк с сотрудниками для получения культуры барвинка розового (Catharantus roseus) собрал 184 образца семян из различных мест произрастания. Из проростков этих семян были отобраны несколько наиболее богатых гипотензивными индольными алкалоидами серпентином и аймалицином (более 0,7 % на сухую массу), из которых были получены каллусные культуры, содержавшие искомых алкалоидов в 4-5 раз больше, чем каллусы, полученные из низкопродуктивных растений.
Однако У.Реллер не обнаружил подобной зависимости в образовании серепентина каллусными культурами, полученными из разных растений барвинка розового.
Японские исследователи также не наблюдали корреляции между содержанием алкалоида берберина в интактных растениях и каллусных культурах василистника (Thalictrum minus).
Возможно, эти противоречивые результаты объясняются тем, что оценка исходного генотипа определялась только по фенотипу.
З.Б. Шамина с сотрудниками использовали для получения клеточных культур изогенную линию мака снотворного (Papaver somniferum). Апикальные меристемы, изолированные одновременно из разных, но одновозрастных растений, культивировались на одинаковых средах. Полученные каллусы существенно различались как по ростовым характеристикам, так и по синтезу алкалоидов.А. Киннесли и Д. Дугелл исследовали синтез никотина в каллусных культурах, полученных от двух различных пар растений табака (Nicotiana tabacum), которые отличались по содержанию никотина и были изогенны по всем другим локусам. Высокий выход никотина дали культуры, инициированные из высокопродуктивных растений. Хотя приведенные данные и противоречивы, но большинство исследователей традиционно учитывают генетическую характеристику ткани.
Однако это вовсе не значит, что в качестве экспланта используется только ткань, богатая искомым веществом, поскольку высокая концентрация вещества может отражать накопление его в ткани путем направленного транспорта, а не как продукт синтеза по месту локализации. Поэтому выбор органа растения для введения его в культуру имеет немаловажное значение. Так, например, содержание стероида диосгенина в культуре клеток диоскореи (Dioscorea floribunda), полученной из клубня, было на порядок выше, чем в культуре клеток из побега. Но зачастую клетки in vitro тотипотентны в отношении синтеза вторичных соединений, то есть любая клетка при создании соответствующих условий культивирования может продуцировать вещества, характерные для исходного растения.
Следует подчеркнуть, что гены, ответственные за регуляцию биосинтеза вторичных метаболитов, присутствуют и в других клетках, обычно их не продуцирующих. В некоторых случаях биосинтетические способности культуры клеток восстанавливались при регенерации растений. Например, культура клеток наперстянки при длительном культивировании утрачивала способность к синтезу гликозидов, а растения, регенерировавшие из этой культуры, восстанавливали их биосинтез. Таким образом, генетическая информация в клетках сохраняется, но для ее реализации требуются специфические условия.
Предполагается, что культивируемые клетки, изолированные из высокопродуктивных растений и тканей, содержат необходимую генетическую информацию для биосинтеза этих метаболитов.
2.2 У культивируемых in vitro клеток могут происходить значительные изменения вторичного метаболизма по сравнению с интактными растениями. Неорганизованно пролиферирующие каллусные клетки в основном характеризуются низким содержанием искомого вещества. В то же время у некоторых растений клетки in vitro продуцируют повышенное количество алкалоидов, например у амми зубной (Ammi visnaga) и некоторых видов дурмана. Не уступает целому растению по содержанию активных веществ и культура клеток женьшеня (Panax ginseng).
У отдельных растений в культуре клеток синтезируются вещества, не обнаруженные in vivo, например, эдулинин и рутакультин у руты душистой (Ruta graveolens) и ароморин у стефании (Stephania cepharantha).
У живокости аяксовой в составе стеринов у культивируемых клеток было обнаружено больше компонентов, чем у растения-донора.
Данные факты говорят о том, что вторичный метаболизм в клетках растений находится в тесной зависимости от процессов развития (цитодиффереренцировки). Изменение вторичного метаболизма в каллусных культурах вызвано, по-видимому, отсутствием дифференциации ткани. Очень часто дифференцированные культуры тканей синтезируют большие количества вторичных веществ, чем недифференцированные. Однако это не является абсолютным правилом. Появляется все больше данных, что органогенез в культуре не является необходимым условием для биосинтеза вторичных метаболитов in vitro. Например, иногда органогенез сопровождается снижением содержания вторичных веществ. Нарушение автотрофности питания при переходе к гетеротрофному типу обмена также может приводить к неполной реализации генетических возможностей клетки.
У целого растений каллусные ткани в течение многих лет сохраняют способность к видоспецифическим биосинтезам.
Клетки растений in vitro характеризуются генетической гетерогенностью, что тоже может быть причиной изменения вторичного метаболизма. Вместе с тем гетерогенность клеточной популяции может играть положительную роль, позволяя отбирать линии клеток с сильно измененными свойствами, в частности, с повышенным синтезом искомого продукта или синтезирующие совершенно новые вещества.
Изменения генома культивируемых клеток могут быть вызваны путем индуцированного мутагенеза. Биохимические мутанты могут быть получены при обработке культуры мутагенами либо антиметаболитами. Так, в результате химического индуцированного мутагенеза и селекции на клеточном уровне в Институте физиологии растений АН СССР были отобраны клеточные линии раувольфии змеиной, содержащей в 10 раз больше антиаритмического алкалоида аймалина, и диоскореи дельтовидной, продуцирующей диосгенин – ценное соединение для фармацевтической промышленности – в тех же количествах, что и корневище интактного растения. В дальнейшем, благодаря применению метода экспериментального мутагенеза и клонирования, штамм диоскореи дельтовидной дал еще более продуктивные клеточные линии.
При обработке культуры антиметаболитами, например аналогами ароматических аминокислот, большинство клеток погибает. Единичные мутантные клетки, выжившие в этих условиях, способны синтезировать избыточное количество метаболита. Так были получены клоны клеток моркови и картофеля, синтезирующие большое количество триптофана, клоны клеток клена белого, продуцирующие много фенилаланина и тирозина.
3 Химические и физические факторы культивирования
Решающими факторами питательной среды, эффективно регулирующими и первичный, и вторичный обмен клеток, являются фитогормоны. В большом количестве работ, посвященных изучению действия фитогормонов, показано, что оно зависит от вида растений, от природы вторичного соединения, от клеточного штамма и т.д. Поэтому результаты экспериментов по влиянию фитогормонов на синтез вторичных метаболитов крайне противоречивы.
М.Ценк с сотрудниками изучали влияние 146 соединений с ауксиновой активностью на рост и образование антрахинонов у культуры клеток моринды лимонолистной (Morinda citrifolia) из семейства мареновых. Они установили, что многие из них поддерживали хороший рост клеток, но только два: a-нафтилуксусная кислота и 2,3,6 –трихлорбензойная кислота – наряду с поддержанием роста стимулировали образование антрахинонов.
Широко применяемым ауксином является 2,4 Д, способный стимулировать как деление, так и растяжение клеток. Однако он может вызывать резкое подавление синтеза продуктов вторичного метаболизма. Варьируя концентрации и типы ауксинов и цитокининов, можно оказать значительное влияние на процессы синтезакаждой конкретной культурой искомого вещества.
Важнейшим фактором среды, влияющим на накопление биомассы, являются углеводы. Поскольку в основном клетки in vitro гетеротрофны, то обычно в качестве источника углерода используется сахароза. Конкурировать с сахарозой может и глюкоза, но все-таки, за редким исключением, рост и высокий уровень биосинтеза в культуре обеспечивает именно сахароза. Повышенные концентрации сахарозы обычно приводят к увеличению выхода вторичных метаболитов. Вместе с тем высокие концентрации сахарозы повышают осмотический потенциал среды, влияние которого на метаболизм культивируемых клеток не изучено. В то же время увеличение содержания сахара в среде удорожает производство, поэтому поиск дешевых углеводных добавок остается актуальным.
Большое влияние на синтез вторичных соединений оказывает минеральный состав среды. При этом наиболее значимыми являются азот, фосфор и калий. Однако их влияние очень специфично как в отношении вида растения, так и в отношении того или иного продукта, о чем свидетельствуют следующие примеры. Так, если у одних культур органические формы азота – пептон, дрожжевой экстракт, гидролизат казеина – тормозят накопление вторичных соединений, то у других – повышают их синтез.
Соотношение аммонийного и нитратного азота в питательной среде также имеет значение. Например, увеличение нитратного азота в среде приводило к повышению синтеза диосгенина культурой клеток диоскореи.
В культуре клеток табака усиливается синтез никотина с уменьшением в среде сахарозы, нитрата и фосфора. Безфосфатная среда способствовала образованию алкалоидов и других вторичных метаболитов в каллусной культуре гармалы. Недостаток фосфата стимулирует синтез вторичных соединений и у некоторых других культур, но имеются данные и противоположного свойства. Безнитратная среда способствовала увеличению синтеза капсаицина каллусной культурой перца кустарникового. Среди трофических факторов положительное значение для биосинтеза вторичных веществ имеют некоторые предшественники самих искомых соединений. Можно предполагать, что при продолжительном культивировании тканей в ограниченном объеме питательной среды, когда снижается способность клеток синтезировать органические вещества, добавление в среду предшественников вторичных соединений должно сказаться на их биосинтезе клетками. В качестве предшественников служат аминокислоты (глутамат, фенилаланин, лейцин, орнитин и др.) и органические кислоты (ацетат, сукцинат, шикимовая и др.). Однако не всегда каллусные ткани используют их. Возможно, имеет значение время внесения предшественника в питательную среду.
Отсутствие желаемого эффекта от внесения в питательную среду предшественников можно объяснить разными причинами: либо они не поглощаются клетками (возможно, клетки синтезируют их сами), либо они распадаются в процессе приготовления и стерилизации среды или переходят в другие физиологические неактивные формы. Не исключено, что предшественники могут оказывать побочные эффекты на рост культуры, в частности, ингибировать его. Для выяснения роли предшественников требуются более тщательные исследо-вания с применением радиоактивной метки. Главным препятствием в этих работах является недостаточное знание путей биосинтеза многих продуктов вторичного метаболизма.
Органические добавки неопределенного состава, такие, как гидролизат казеина и кокосовое молоко, могут оказывать буферное действие. Буферная емкость сред очень низкая, поэтому величина исходного рН (5-6) при культивировании быстро сдвигается на несколько единиц, а это, в свою очередь, сказывается на биосинтетических свойствах и способности к накоплению продукта культивируемых клеток.
Таким образом, оптимизация питательной среды является ключевым моментом в повышении выхода продукта. Результатом подобных исследований являются так называемые продукционные среды, на которых культивируемые клетки при незначительном или полном отсутствии деления клеток синтезируют значительные количества метаболитов.
Физическими факторами, влияющими на накопление вторичных метаболитов клетками, являются свет, температура, аэрация и режим перемешивания в случае суспензии, газовый состав в колбах. Стимулирующее действие света на образование вторичных соединений в культуре клеток показано на примере каротиноидов, эфирных масел, коричных масел, флаваноидов, пластохинонов, антоцианов, катехинов, алкалоидов, витаминов. Свет активировал ферменты фенольного метаболизма, не влияя при этом на ферменты углеводного и липидного обмена.
Имеет значение качество света. Так, например, очень эффективным для накопления вторичных веществ культурой клеток петрушки было непрерывное их освещение люминесцентным светом типа «холодный белый». Синтез флавоновых гликозидов клетками петрушки был особенно чувствителен к ультрафиолетовому свету с длинами волн ниже 320 нм и последующему облучению светом в области «красный –длинноволновый красный». По-видимому, в этой культуре более активна низкоэнергетическая фитохромная система. Синий свет увеличивал образование антоцианов в культуре клеток гаплопаппуса. В некоторых случаях свет оказывал ингибирующее действие, подавляя синтез алкалоидов у дурмана и скополии, снижая содержание никотина в каллусах табака, алкалоидов – в культурах клеток хинного дерева, шиконина – в культуре клеток воробейника. Имеются сведения о влиянии освещения на соотношение разных классов вторичных соединений, а также данные об отсутствии светового и темнового воздействия на накопление вторичных метаболитов.
Данных о влиянии температуры на рост и биосинтезы клеточных культур очень мало. Однако тот факт, что температура оказывает действие на вторичный метаболизм интактных растений, говорит о необходимости исследований в этом направлении. Тем более что температурные оптимумы для роста культуры клеток и биосинтезов не всегда совпадают. Так, например, наилучший рост каллусов гармалы наблюдался при 30 оС, а максимум образования алкалоидов достигался при 25 оС.
Накопление клетками вторичных продуктов метаболизма является результатом динамического равновесия между биосинтетическим, биотрансформационным и биодеградационным процессами. Влияние внешних и внутренних факторов на каждый из этих процессов сложно из-за отсутствия фундаментальных знаний не поддается контролю. Поэтому следует признать оправданным тот эмпирический подход при изучении влияния факторов культивирования на накопление вторичных веществ, который распространен в настоящее время.
Дата добавления: 2015-07-14; просмотров: 2197;
