Производство непредельных углеводородов
Производство ацетилена С2Н2
С2Н2 – бесцветный газ со слабым эфирным запахом, tокип = –84о, взрывоопасен. Является исходным продуктом в целом ряде важнейших синтезов.
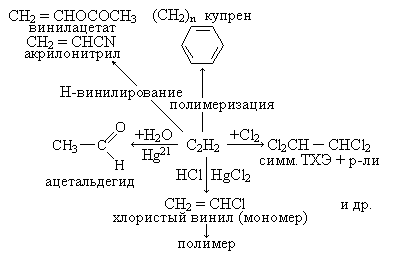
Таким образом, исходя из ацетилена и продуктов его первичных превращений, можно получить широкий круг ценных продуктов, включающий ПМ, химимические волокна, СК, растворители и т.д.
Отличительной особенностью ацетилена в отличие от Н2 и углеводородов является его хорошая растворимость в воде и полярных органических растворителях, что используется при его получении и транспортировке.
| 20оС VC2H2 на 1 V | |
| 1 объем Н2О | |
| бензин | |
| СН3СОСН3 | |
ДМФА
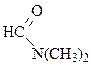
| |
N-метилпирролидон
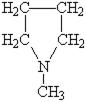
|
Ацетилен получают в промышленности следующими методами.
- Карбидный метод.
Метод существует с конца XIX века и не потерял ещё своего значения. Он протекает следующим образом:
CaO + 3C = CaC2 + CO
CaC2 + 2H2O = C2H2 + Ca(OH)2 + 127 кДж/моль
Из 1 кг технического CaC2 получают 230-280 л C2H2. Теоретический выход из чистого CaC2 – 380 л. Реакция гетерогенная, и её скорость, в основном, зависит от размера кусков карбида.
Полученный ацетилен содержит примеси NH3, H2S, PH3 и др., образующиеся вследствие разложения водой соединений кальция. Эти примеси необходимо удалить, так как они отравляют катализаторы, которые принимают участие в синтезах на основе ацетилена.
- Получение из углеводородов при их термическом расщеплении.
Метод разработан в 50-е годы XX века и является важным этапом вразвитии синтезов на основе ацетилена.
Ацетилен из метана и других парафинов образуется по следующим обратимым реакциям:
2CH4  C2H2 + 3H2 – 376 кДж/моль
C2H2 + 3H2 – 376 кДж/моль
С2Н6  С2Н2 + 2Н2 – 311 кДж/моль
С2Н2 + 2Н2 – 311 кДж/моль
С3Н8  С2Н2 + СН4 + Н2 – 255 кДж/моль
С2Н2 + СН4 + Н2 – 255 кДж/моль
Все эти реакции эндотермичны и их равновесие сдвигается вправо только при 1000─1500оС и более для высших углеводородов.
Механизм реакций пиролиза еще недостаточно ясен, но установлено, что он протекает с образованием радикалов. Примерную цепь превращений метана, этана и пропана можно представить так:
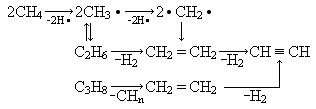
В качестве примесей присутствуют бензол и углеводороды ацетиленового ряда – алкины. Получение ацетилена данным методом значительно осложняется экзотермической реакцией его распада на простые вещества
С2Н2 = 2С + Н2
протекающей интенсивно при 1200–1600оС, то есть при температуре, требуемой для синтеза. Поэтому используют метод снижения степени конверсии исходного сырья и закалки продуктов.
По способу подвода тепла, необходимого для реакции, различают 2 метода синтеза С2Н2.
- Окислительный пиролиз.
При окислительном пиролизе эндотермичность реакции образования ацетилена компенсируется экзотермической реакцией окисления части углеводорода
СН4 + 2О2 = СО2 + 2Н2О + 803 кДж/моль
причем все реакции протекают одновременно. Этот метод является наиболее перспективным, хотя содержание ацетилена в получаемом газе невелико.
Наряду с основными реакциями происходит конверсия углеводородов водяным паром
СН4 + H2О  СО + 3Н2
СО + 3Н2
С2Н2 + 2Н2О  2СО + Н2
2СО + Н2
Эти реакции, а также разложение ацетилена, являются побочными.
Соотношение СН4 : О2 = 100 : 65, применение вместо кислорода воздуха нерационально.
Схема реактора окислительного пиролиза следующая:
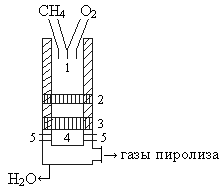
- Смесительная камера
- Огнепреградительная решетка
- Горелочная плита
- Камера сгорания
- Форсунки
Метан и кислород, предварительно нагретые до 500оС поступают в смесительную камеру 1. Во избежание преждевременного воспламенения газов имеется огнепреградительная решетка 2, к тому же скорость подачи газа (65 м/с) превышает скорость распространения пламени. Закалка реакционных газов в камере сгорания производится путем впрыска в камеру воды через форсунки 5. Время пребывания газов в камере составляет ~3•10-3 сек – 3 мс.
- Электрокрекинг при помощи вольтовой дуги, либо плазмы
Синтез проводится в электродуговых печах постоянного тока.
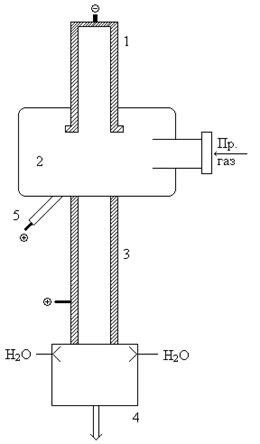
- Катод
- Реакционная камера
- Заземленный анод
- Закалочная камера
- Пусковой анод
Исходная газовая смесь с большой скоростью (~100 м/с) входит в вихревую камеру и как бы втягивает дугу в кольцевое пространство рабочего анода. В этом аноде и происходит пиролиз. В закалочной камере происходит впрыск воды и быстрая закалка продуктов реакции. Конверсия металла за один пропуск составляет ~40-50 %. Выход энергии 10 кВт•ч на 1 кг ацетилена.
Реакционные газы, полученные при любом методе, имеют сложный состав и содержат 7-14 % С2Н2. Остальными компонентами являются Н2, СН4, С2Н4, С6Н6, гомологи ацетилена, СО2, СО.
Для выделения ацетилена используют селективные растворители ДМФА или N-метилпирролидон. Вначале газ очищают от сажи, а затем выделяют из него диацетилен, который способен самопроизвольно взрываться, а после этого проводят абсорбцию ацетилена при повышенном давлении и десорбцию при нагревании. В заключение очищают ацетилен от СО2 этаноламинами. В результате получается концентрированный ацетилен (99 об.% С2Н2).
20°
НО – СН2 – СН2 – NН2 + СО2  НО – СН2 – СН2 – NН2 • СО2
НО – СН2 – СН2 – NН2 • СО2
80°
Дата добавления: 2015-06-17; просмотров: 1792;
