Синтез метанола СН3ОН
Метанол – бесцветная жидкость (tкип = 65°С) с запахом, подобным запаху этанола. Смешивается во всех отношениях с водой и многими органическими растворителями. Чрезвычайно токсичен.
Раньше метанол получали сухой перегонкой древесины (древесный спирт), но в настоящее время этот синтез полностью вытеснен синтезом на основе синтез-газа.
Основное количество метанола расходуется на производство формальдегида. Он также является промежуточным продуктом при синтезе сложных эфиров (метилметакрилата, диметилтерефталата) и применяется как метилирующий агент (получение метиламинов, диметиланилина).
Образование метанола из СО и Н2 происходит по обратимой экзотермической реакции:
CO + H2  CH3OH + 111 кДж/моль
CH3OH + 111 кДж/моль
В связи с экзотермичностью процесса Кр падает с повышением температуры до 250°С. При низких температурах, когда равновесие сильно смещено в сторону образования спирта, реакция протекает слишком медленно, и не существует катализаторов, которые могли бы ускорить её при этих условиях. Основные применяемые катализаторы ZnO и ZnO+Cr2O3 (8:1) становятся активными только при 300-400°С, когда Кр мала. Поэтому приходится повышать давление, так как реакция идет с уменьшением объёма. Выход СН3ОН в зависимости от Р и Т отражается схемой:
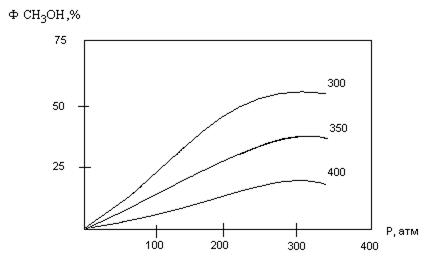
Ввиду больших энергетических затрат на сжатие, в промышленности обычно работают при 200-350 атм. Для каждого давления существует своя определенная температура (обычно 370-470°С), при которой наблюдается максимальная скорость образования метанола. Производительность аппаратуры регулируют также изменением объемной скорости движения исходной смеси (т. е. временем контакта с катализатором). Так снижение времени контакта с 120 до 10 сек. вызывает увеличение производительности с 0.17 до 0.75 кг СН3ОН на 1 кг катализатора в час. Фактическая степень конверсии составляет 10-20%. Непрореагировавший синтез – газ вновь возвращается на переработку, т.е. в данном случае синтез можно осуществить по циркуляционной схеме, он имеет много общего с синтезом NH3 из Н2 и N2.
На цинк-хромовых катализаторах в качестве побочных веществ образуется диметиловый эфир (за счет межмолекулярной дегидратации метанола), метан (как продукт гидрирования метанола и СО), двуокись углерода и вода.
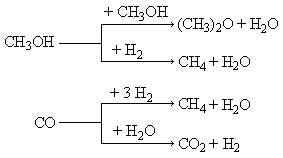
Селективность реакции составляет 90%.

Основной частью технологической схемы является контактный аппарат, в котором катализатор располагается на полках, в пространстве между которыми вводится дополнительное количество холодного синтез – газа для снижения температуры смеси. Для удобства замены катализатора и во избежание ослабления корпуса аппарата, рассчитанного на работу при высоком давлении, полки с катализатором размещаются в специальной коробке, а входы и выходы газов смонтированы в нижней части колонки.
Для предохранения от водородной коррозии корпус выполняется из высоколегированной стали. Это же необходимо для снижения образования пентакарбонила железа Fe(CO)5, который при разложении выделяет пирофорное железо, катализирующее реакции образования метана и СО2.
Получаемый метанол-сырец имеет следующий состав:
СН3ОН 0.3-0.5 %
Н2О 3-5 %
(СН3)2О 1 %
R-OH 0.4-1 %
При простой ректификации из сырца удаляют летучий диметиловый эфир и тяжелый остаток из высших спиртов. Далее следует экстрактивная перегонка с водяным паром для отделения от других примесей. От воды спирт отгоняется с острым паром.
Общий выход составляет ~85 %.
Дата добавления: 2015-06-17; просмотров: 1926;
