Синтез формальдегида CH2O
Формальдегид – бесцветный газ с острым раздражающим запахом, является лакрематором (вызывает слезотечение), tкип=–19°С. При хранении легко полимеризуется, образуя параформ. 37%-ный раствор формальдегида в воде называется формалином.
Основное применение формальдегид находит в производстве фенолформальдегидных смол, лаков, красок, полимера формальдегида, ТГФ (тетрагидрофурана), пирролидона, ненасыщенных спиртов, лекарственных средств и т.д.
Основным технологическим способом получения формальдегида в настоящее время является окислительное дегидрирование метанола. Основные процессы, протекающие в таком синтезе, можно описать двумя реакциями:
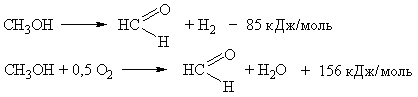
Можно максимально подобрать соотношения этих реакций, чтобы суммарный тепловой эффект процесса был немногим больше нуля, но достаточным для нагревания реакционной смеси до нужной температуры и компенсации потери тепла в окружающую среду.
Практически это выполняется когда процесс на 55% идет через окисление и на 45% через дегидрирование, и тогда такое превращение можно осуществить в адиабатическом реакторе. В этом состоит одно из преимуществ совмещения процесса окисления и дегидрирования спиртов.
При указанном соотношении реакций на один объём паров метанола потребуется 0,55 • 0,5 • 100/21 = 1,3 объема воздуха, что находится за верхним пределом взрываемости смеси CH3ОН – воздух.
Кроме основных процессов протекают побочные реакции более глубокого окисления, дегидрирования и гидрирования:
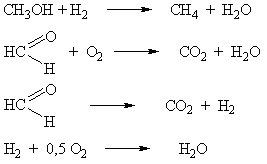
Ввиду того, что процесс ведут при недостатке кислорода, глубокое окисление не получает значительного развития, и сам синтез можно проводить при более высокой температуре 500 – 600ºС с временем контакта смеси 0,01 – 0,03 секунды. Выход СН2О достигает 80–85%.
Катализатором для процесса получения формальдегида служит металлическое серебро, нанесенное на пемзу.
Второе преимущество данного метода в том, что продуктом синтеза является водный раствор формальдегида, стабилизированный метанолом, который остается после реакций.
Дата добавления: 2015-06-17; просмотров: 4102;
