Аммиакты синтездеудің физика-химиялық негізі.
Аммиакты синтездеу реакциясының жылу эффектісі температурамен қысымға байланысты. 5000С температурада әртүрлі қысымда есептелген жылу эффектісі мына төмендегідей.
| Р,МПа | 0,1 | ||||
| Q,кДж 1моль NH3 | 50,2 | 52,0 | 55,8 | 61,4 | 68,8 |
Аммиакты синтездеу - көлемді азайтып жылу бөліп жүретін қайтымды процесс, яғни қысымды көбейтіп, температураны төмендету, тепе-теңдікті оңға жылжытады. Таза азот пен сутек қатынасы 1:3 болғанда, температура мен қысымға байлынысты аммиактың шығымы мынадай болады.
| Температура0С | Аммиак шығымы,% | Темпера тура 0С | Аммиак шығымы,% | ||
| 30 МПа | 100 МПа | 30 МПа | 100 МПа | ||
| 89,94 | 98,29 | 26,44 | 57,47 | ||
| 70,96 | 92,55 | 13,77 | 31,43 | ||
| 47,00 | 79,82 | 7,28 | 12,83 |
Бұл таблицадан көретініміз температураның өсуімен аммиак шығымы азайады, ал қысымның арттыруымен көбейеді.
Азот пен сутек реакцияласу процесінің жылдамдыығы азоттың активтілігіне байланысты екені анықталған. Азотты активтеу энергиясы өте жоғары. Оны төмендету үшін катализаторлар қолданылады. Аммиак синтезіндегі катализатор әсерінің механизмі мынандай сатылардан тұрады.
1. Азот пен сутек газ фазасынан катализатордың беткі қабатына және кеуегіне дифффузияланады.
2. Азот пен сутек катализатордың әсерімен активтелінеді.
3. Катализатор бетінде активтелген азот пен сутек әрекеттеседі. Осының нәтижесінде азот катализатордан электронды қосып алыптеріс зарядталады, N + e 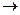 N- Сутек өз электроның беріп оң зарядталады Н –е
N- Сутек өз электроның беріп оң зарядталады Н –е 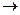 Н+ Зарядталған сутек пен озот реакцияласып алғашында NH (имид) содан соң NH2 (амид) , ең соңында аммиак NH3 түзеді.
Н+ Зарядталған сутек пен озот реакцияласып алғашында NH (имид) содан соң NH2 (амид) , ең соңында аммиак NH3 түзеді.
4.Түзілген аммиак катализатордан десорбциаланып газ фазасына ауысады.
Процестің анықтаушы сатысы азоттың активтелген адсобциясы. Амиактың шығымы технологиялық режимнің мынандай параметрлеріне байланысты.
1. Температура
2. қысым
3. Катализатордың газбен жанасатын уақыты.
4. Газдың көлемдік жылдамдығы.
5. Газ қоспасының құрамы.
6. Катализатордың активтілігі.
7. Аппарат конструкциясы.
Егер система тепе-теңдік жағдайына жақын болса, онда темір катализаторында процестің жылдамдығы Темкин теңдеуі бойынша анықталады.
U= 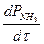 = K1 PN2(P3H2 / P2NH3)a - K2 ( P2NH3 / P3H2)1-a
= K1 PN2(P3H2 / P2NH3)a - K2 ( P2NH3 / P3H2)1-a
Мұндағы, К1- аммиактың түзілу жылдамдығының тұрақтысы.
К2 – аммиактың ыдырау жылдамдығының тұрақтысы.
РN2,PH2,PNH3 – азот, сутегі, аммиактың парциалдық қысымы.
? ? –0< ? <1, азоттың катализаторға адсобциялау мөлшеріне тәуелді коэффициент, темір катализаторы үшін-0,5- ке тең. Егер 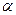 =0 болса онда реакция кері бағытта жүреді,
=0 болса онда реакция кері бағытта жүреді, 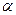 = 1 болса реакция аммиак түзіетін жаққа қарай жүреді. К1/ К2 қатынасы К1/ К2 = Кт-т
= 1 болса реакция аммиак түзіетін жаққа қарай жүреді. К1/ К2 қатынасы К1/ К2 = Кт-т
Кт-т - аммиактың түзілу реакциясының тепе-теңдік коэффициенті.
К- температураға, катализатор активтілігіне және оның размеріне тәуелді.
Жоғары қысымда К – жалпы қысымның функциясы болады. Негізінене катализатор активтілігі К1- пропорцианал К- ның мәнімен анықталады.
| Р,МПа | 0,1 | ||||
| К/К0 | 1.0 | 0,92 | 0,80 | 0,75 | 0,65 |
К0- К –ның атмосфералық қысымдағы мәні.
Аммиак шығымына температура мен қысымнан басқа да көлемдік жылдамдықта әсер етеді. Көлемдік жылдамдық өлшемі м3/м3.с = сағ-1 Көлемдік жылдамдықтың өзіне тән оптималдық температурасы болады. Оны мына графиктен көруге болады.
Дата добавления: 2015-06-17; просмотров: 5371;
