Характеристика модификаций гипсовых вяжущих
| Модификация сульфата кальция | Температура, К | Nд | Nр | Плотность кг/м3 | рН водного раствора | |
| образования | дегидратации | |||||
| a-CaSO4 · 0,5H2O | 473-783 | 1,583 | 1,559 | 2720-2730 | 6,60 | |
| b-CaSO4 · 0,5H2O | 443-453 | 1,556 | 1,550 | 2670-2680 | 3,90 | |
| a-CaSO4 | 473-483 | - | 1,579 | 1,554 | - | |
| b-CaSO4 | 443-453 | - | 1,570 | 1,546 | 5,74 | |
| Ангидрит CaSO4 | 773 и выше | - | - | - | 2900-3100 | 6,50 |
Кроме того, это сказывается на содержании цеолитной воды. Так, у обеих модификаций теоретическое содержание кристаллизационной воды равно 6,21% от массы полугидрата. Однако общее количество связанной (с учетом цеолитной) у a - CaSO4 · 0,5H2O составляет 8%, а у b - CaSO4 · 0,5H2O до 12%.
Таким образом, общая водопотребность у b - CaSO4 · 0,5H2O будет выше, а следовательно, избыточная вода, добавленная к вяжущему сверх стехиометрии по реакции CaSO4 · 0,5H2O + 1,5Н2О =
= CaSO4 · 2H2O в дальнейшем неизбежно испаряется, поризуя при этом затвердевшее изделие и, тем самым, снижая его прочность.
Кристаллы a - CaSO4 · 0,5H2O имеют большую плотность, и хотя они медленнее гидратируются, но вследствие меньшего количества избыточной воды против стехиометрии обладают более высокой прочностью.
Общим структурным мотивом сульфата кальция является цепочка Ca-SO4-Ca-SO4 с расстоянием между ионами 0,31-0,32 нм, которые при обезвоживании до полугидратных модификаций сохраняют свою ориентацию.
Повышение температуры термообработки CaSO4 · 2H2O до 170-180°С и 200-210°С приводит к образованию обезвоженных полугидратов соответственно b и a модификации. Эти превращения не приводят к изменению кристаллической решетки продуктов, на что указывает идентичность их рентгенограмм. Обезвоженные полугидраты обладают высокой гигроскопичностью и при хранении на воздухе легко превращаются вновь в водные полугидраты. Эти модификации существуют в узком интервале температур и практического значения не имеют.
При дальнейшем повышении температур до 220°С a - CaSO4 · 0,5H2O превращается в растворимый a - CaSO4. Аналогичный процесс претерпевает при 300°С b - CaSO4 · 0,5H2O, превращаясь в растворимый b - CaSO4. При этом расстояние между соседними ионами Са2+ и SO 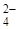 несколько увеличивается. Растворимые ангидриты вследствие перестройки моноклинной кристаллической решетки в ромбическую имеют более высокую по сравнению с полугидратными модификациями удельную поверхность и, как следствие, на 20-30% большую водопотребность. Из этого вытекает важная для технологии рекомендация о крайней нежелательности повышения оптимальных температур при получении полугидратных модификаций во избежание образования растворимых ангидритов.
несколько увеличивается. Растворимые ангидриты вследствие перестройки моноклинной кристаллической решетки в ромбическую имеют более высокую по сравнению с полугидратными модификациями удельную поверхность и, как следствие, на 20-30% большую водопотребность. Из этого вытекает важная для технологии рекомендация о крайней нежелательности повышения оптимальных температур при получении полугидратных модификаций во избежание образования растворимых ангидритов.
В растворимых ангидритах при температуре выше 400°С расстояние между вышеуказанными ионами уменьшается и они превращаются в нерастворимые, которые имеют структуру, аналогичную природному ангидриту. Этот процесс сопровождается уменьшением удельной поверхности и, как следствие, снижением водопотребности, удлинением сроков схватывания и твердения. Нерастворимый ангидрит самостоятельно практически не гидратируется и не твердеет.
Повышение температуры термообработки выше 750°С приводит к существенному изменению свойств продукта, который приобретает способность схватываться и твердеть. В интервале 900-1000°С начинается частичная диссоциация сульфата кальция, что приводит к появлению в составе продукта свободного СаО в количестве 2-3%. Нерастворимый ангидрит b - CaSO4 является основным компонентом высокообоженного гипса (эстрих-гипса), который обладает способностью схватываться и твердеть благодаря присутствию в его составе свободного СаО. Выше 1180°С b-нерастворимый ангидрит переходит в a - CaSO4, который при 1495°С плавится и полностью разлагается на СаО, SO2 и О2 по реакции CaSO4 ® СаО + SO2 + ½О2.
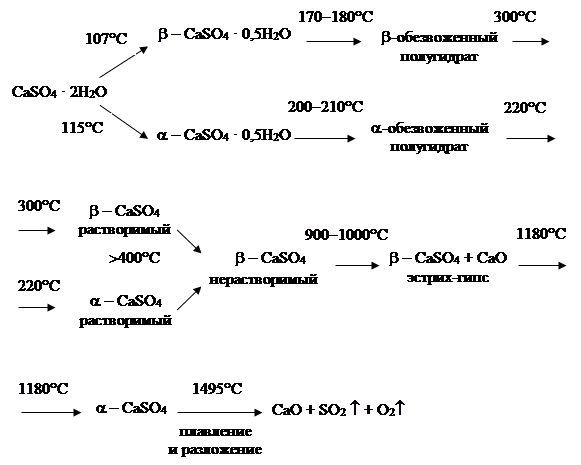
Подытоживая вышеизложенное, схему термохимических превращений дигидрата сульфата кальция можно представить следующим образом (рис. 1.6).
 | |||
 | |||
Рис. 1.6. Схема термохимических превращений дигидрата сульфата кальция
Указанные на вышеприведенной схеме температуры термохимических превращений CaSO4 · 2H2O носят ориентировочный характер, т. к. на их значение оказывают влияние примеси, которые в том или ином «ассортименте» присутствуют в сырье, особенно природном. Кроме того, значение температур зависит от условий рентгенографического анализа. Приведенные величины температур отражают прошедшие термохимические превращения, а рентгенографическая съемка образцов проводилась на охлажденных образцах, т. е. при комнатной температуре. Для исследования необратимых процессов такой подход к рентгенографии вполне корректен. В случае высокотемпературной рентгенографии продуктов дегидратации дигидрата сульфата кальция, в недавно выполненном исследовании сотрудниками Белгородского государственного технологического университета им. В. Г. Шухова, указывается на значительно более низкие температуры превращений по сравнению с обычным режимом съемки.
В заводских условиях вследствие невозможности создания в реакционном объеме совершенно однородного теплового поля целевой продукт будет иметь всегда полиминеральный состав, т. е. в который входит при получении строительного гипса не только
b - CaSO4 · 0,5H2O, но и растворимый CaSO4, а также остатки исходного CaSO4 · 2H2O.
Знание физико-химических основ дегидратации гипса позволили обосновать выбор типов основных технологических аппаратов, которые могут обеспечить соблюдение тех или иных технологических режимов, с помощью которых возможно получение целевого продукта требуемого качества. Иными словами, речь идет о различных технологиях производства гипсовых вяжущих.
Дата добавления: 2015-06-17; просмотров: 2201;
