Физико-химические основы процесса
дегидратации CaSO4 · 2H2O
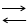 Как уже отмечалось выше, получение гипсовых вяжущих базируется на обезвоживании дигидрата сульфата кальция по реакции CaSO4 · 2H2O CaSO4 · 0,5H2O + 1,5H2O. На кривой ДТА (рис. 1.3) видны температурные интервалы ступенчатого удаления кристаллизационной воды.
Как уже отмечалось выше, получение гипсовых вяжущих базируется на обезвоживании дигидрата сульфата кальция по реакции CaSO4 · 2H2O CaSO4 · 0,5H2O + 1,5H2O. На кривой ДТА (рис. 1.3) видны температурные интервалы ступенчатого удаления кристаллизационной воды.
Рис. 1.3. Дериватограмма CaSO4 · 2H2O
Первый эндотермический эффект с минимумом при 170°С связан с удалением 3/4 воды из гипса. Второй эндотермический эффект при 180°С менее интенсивен и связан с удалением остального количества кристаллизационной воды, что согласуется с потерей массы на кривой ТГ. При температуре 355°С наблюдается экзотермический эффект, обусловленный образованием нерастворимого ангидрита b - CaSO4 из растворимого. Дальнейшее повышение температуры вплоть до 1200°С не вызывает протекания процессов, связанных с выделением или поглощением теплоты. В интервале температур регистрируется небольшой эндоэффект с минимумом 1200°С, связанный с переходом b - CaSO4 в a - CaSO4. При температуре 1380°С происходит плавление CaSO4 · СаО ранее образовавшегося за счет частичного разложения CaSO4 на СаО и SO2. Этот процесс, связанный с затратой энергии, регистрируется на кривой ДТА в виде эндоэффекта.
1.4.1. Равновесие реакции дегидратации CaSO4 · 2H2O.
Качественную оценку влияния технологических параметров на равновесие обратимой эндотермической реакции дегидратации
CaSO4 · 2H2O можно дать исходя из фундаментальных законов. Поскольку целевым продуктом в этом процессе является полугидрат сульфата кальция, то и действие технологических параметров – концентрации, температуры и давления – должно быть направлено на сдвиг равновесия в правую сторону. Исходя из этого, температуру следует повышать (принцип Ле-Шателье), концентрацию исходного реагента, т. е. содержание CaSO4 · 2H2O в гипсе, как следует из выражения константы (Кс), также необходимо повышать, например, путем обогащения сырья, а давление в связи с тем, что реакция идет с увеличением числа молей, необходимо понижать.
Для количественной характеристики равновесия данной реакции используют термодинамические расчеты, выполняемые согласно уравнению, отражающему зависимость теплоемкости (Ср) от температуры.
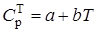 .
.
Значения коэффициентов (а) и (b) приведены в табл. 1.12.
Величины энтальпии реакций образования соединений и энергии Гиббса для соединений, участвующих в реакциях обезвоживания гипса, приведены в табл. 1.13.
Таблица 1.12
Дата добавления: 2015-06-17; просмотров: 2632;
