Значения коэффициентов в уравнениях
| Соединения | 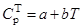
| |
| а | b | |
| CaSO4 · 2H2O | 91,51 | 0,318 |
| a- CaSO4 · 0,5H2O | 71,02 | 0,163 |
| b- CaSO4 · 0,5H2O | 48,10 | 0,256 |
| CaSO4 | 59,08 | 0,138 |
| H2O(г) | 31,22 | 0,008 |
| H2O(ж) | 75,50 | - |
Таблица 1.13
Значения 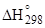 и
и 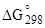 для сульфатов кальция, кДж/моль
для сульфатов кальция, кДж/моль
| Соединения | 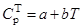
| |
-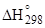
| -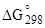
| |
| CaSO4 · 2H2O | 2021,12 | 1795,73 |
| a- CaSO4 · 0,5H2O | 1575,15 | 1435,20 |
| b- CaSO4 · 0,5H2O | 1573,06 | 1439,19 |
| a- CaSO4 | 1423,69 | 1311,77 |
| b- CaSO4 | 1419,25 | 1307,33 |
| CaSO4 | 1432,69 | 1320,30 |
| H2O(г) | 241,83 | 228,59 |
| H2O(ж) | 285,84 | 237,19 |
Пример. Рассчитать энтальпию и энергию Гиббса реакции
CaSO4 · 2H2O ®a-CaSO4 · 0,5H2O+ 1,5H2O(ж).
Определяем значения 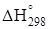 и
и 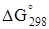 .
.
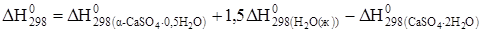 ;
;
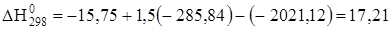 кДж/моль;
кДж/моль;
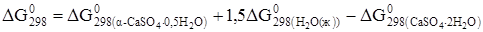 ;
;
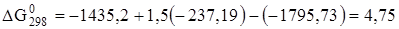 кДж/моль.
кДж/моль.
Находим значения коэффициентов в уравнении
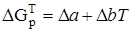 .
.
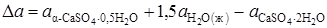 ;
;
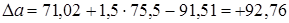 .
.
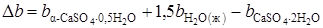 ;
;
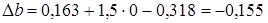 .
.
Зависимость энергии Гиббса реакций дегидратации
CaSO4 · 2H2O определяют по уравнению
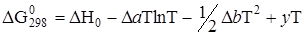 ,
,
где DН0 и у – константы интегрирования, которые находят из уравнений
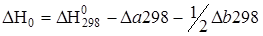 ;
;
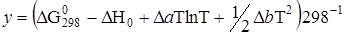 ;
;
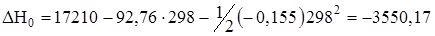 ;
;
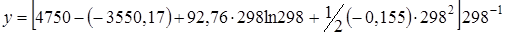 ;
;
y= 533,22;
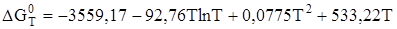 .
.
Найденные по этому уравнению значения 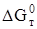 составляют 4750 Дж/моль при 298 К, 1239,86 Дж/моль при 373 К, 4231,38 Дж/моль при 473 К.
составляют 4750 Дж/моль при 298 К, 1239,86 Дж/моль при 373 К, 4231,38 Дж/моль при 473 К.
Подобным образом рассчитывают зависимость 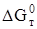 от температуры и для других реакций дегидратации CaSO4 · 2H2O. Эти данные представлены в табл. 1.14 и 1.15.
от температуры и для других реакций дегидратации CaSO4 · 2H2O. Эти данные представлены в табл. 1.14 и 1.15.
Таблица 1.14
Значения энергии Гиббса реакций дегидратации CaSO4 · 2H2O
| № реакции в табл. 1.15 | Значение 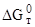 (Дж/моль) при температуре, °К (Дж/моль) при температуре, °К
| |||
| 1239,86 | –1414,75 | –4231,38 | ||
| 1312,01 | –9356,58 | –19923,12 | ||
| 9525,69 | –4683,12 | –18659,73 | ||
| –3430,92 | –6876,68 | –10574,89 |
Таблица 1.15
Зависимость энергии Гиббса (Дж/моль)
от температуры реакций дегидратации гипса CaSO4 · 2H2O
| Уравнение реакции | 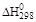
| 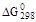
| 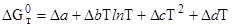
| |||
| Dа | Db | Dc | Dd | |||
| 1. CaSO4 · 2H2O ® a-CaSO4 · 0,5H2O + + 1,5H2O(ж) | 17 210 | 4 750 | –3550,17 | –92,76 | 0,0775 | 533,22 |
| 2. CaSO4 · 2H2O ® b-CaSO4 · 0,5H2O + + 1,5H2O(г) | 83 225 | 17 645 | 81725,17 | –26,34 | 0,0715 | –86,28 |
| 3. CaSO4 · 2H2O ® ® b-CaSO4 2H2O (г) | 118 210 | 31 220 | 116548,25 | –30,01 | 0,082 | –139,803 |
| 4. CaSO4 · 2H2O ® ® a-CaSO4 2H2O (ж) | 16 750 | 1 050 | –10591,5 | –118,57 | 0,09 | –687,749 |
Теоретический расход теплоты составляется от 118210 Дж/моль для дегидратации CaSO4 · 2H2O с образованием b - CaSO4 и 2Н2О (г) до 16750 Дж/моль для реакции обезвоживания с получением CaSO4 и 2H2O (ж).
Термодинамическая вероятность осуществления реакций дегидратации (когда 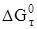 < 0) появляется только при нагревании до температуры выше 373 К, но ниже 423 К.
< 0) появляется только при нагревании до температуры выше 373 К, но ниже 423 К.
Давление паров Н2О рассчитывают, исходя из выражения константы равновесия (Кр)

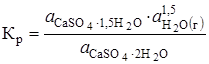 ,
,
где а - активность, значение которой при небольших давлениях aН2О @ рН2О. Активность твердых фаз - CaSO4 · 2H2O и CaSO4 · 1,5H2O принимают равными единице, тогда 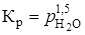 , а
, а 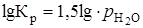 . Поскольку
. Поскольку 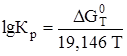 , то
, то 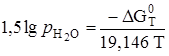 , отсюда
, отсюда 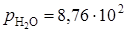 Па.
Па.
При 373 К давление паров Н2О для реакции с образованием a - CaSO4 · 0,5H2O равно 7,6 · 104 Па, а для образования a - CaSO4
4,5 · 102 Па.
Указанные расчетные данные свидетельствуют о том, что давление паров Н2О в реакциях обезвоживания гипса достигает при 373 К значительной величины, хотя и ниже атмосферного. Практически, как будет показано ниже, дегидратацию проводят при более высокой температуре.
1.4.2. Кинетика реакции дегидратации CaSO4 · 2H2O
Скорость протекания любой реакции влияет на производительность реактора, в котором она осуществляется, и, тем самым, на экономические показатели. Следовательно, одной из важнейших задач является создание условий, обеспечивающих протекание реакции не только с максимальным выходом целевого продукта, при управлении равновесием, но и наибольшей скоростью.
С увеличением температуры скорость реакции в соответствии с уравнением Аррениуса 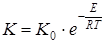 возрастает, так же как и с увеличением концентрации, т. е. содержания основного вещества в гипсе. Рост концентрации исходных реагентов обеспечивает увеличение скорости химической реакции, что вытекает из закона действующих масс.
возрастает, так же как и с увеличением концентрации, т. е. содержания основного вещества в гипсе. Рост концентрации исходных реагентов обеспечивает увеличение скорости химической реакции, что вытекает из закона действующих масс.
Механизм и кинетика процесса дегидратации CaSO4 · 2H2O имеют различный характер в зависимости от технологических условий его проведения. В свою очередь, кинетику дегидратации
CaSO4 · 2H2O следует рассматривать на молекулярном уровне и макрокинетику.
Исходя из теории валентности структурная формула гипса может быть представлена следующим образом (рис. 1.4).
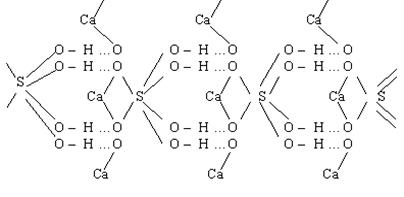
Рис. 1.4. Структурная формула гипса
Из представленной формулы видно, что атомы кислорода и водорода молекул воды связаны между собой валентными связями, а водорода и кислорода смежных молекул - силами водородной связи (…). В связи с тем, что прочность водородных связей намного меньше прочности валентных связей, то элементарный акт дегидратации гипса начинается именно с разрыва водородных связей. В свою очередь, разрыву водородных связей предшествует расшатывание кристаллической решетки гипса за счет «перескоков» протонов.
Таким образом, на молекулярном уровне процесс дегидратации гипса начинается с элементарного акта протонной перегруппировки ОН-групп, которая может быть представлена следующим уравнением:
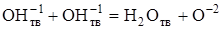 .
.
Развитие протонной перегруппировки в активных центрах и вокруг них обеспечивает накопление адсорбированных молекул воды и увеличение концентрации ионов радикалов О2– в активных центрах кристаллов гипса. В результате этого происходит пересыщение зародышей твердой фазы по отношению к полугидрату и он выкристаллизовывается из нее, как это вытекает из теории топохимических реакций.
Вместе с тем при дегидратации гипса образуются квазичастицы – экситоны, представляющие собой связанное состояние электронов проводимости и вакансии (дырки), обладающие подвижностью. Поэтому электроны и вакансии могут захватываться соседними активными центрами, рекомбинировать и создавать новые вакансии, по которым диффундируют газообразные молекулы кристаллизационной воды. Отсюда следует, что второй элементарный акт процесса дегидратации гипса связан с разрушением водородных связей и диффузией воды из кристаллической решетки гипса с образованием в ней анионных вакансий по схеме
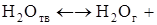 .
.
По сравнению с относительно легким и беспрепятственным удалением газообразных молекул воды, переход протонов из одного активного центра к другому затруднен. Именно поэтому и происходит удерживание воды продуктами дегидратации гипса до довольно высоких температур. Действительно, одной молекуле CaSO4 дигидрата
сульфата кальция труднее удерживать две молекулы воды, чем впоследствии двум молекулам CaSO4 полугидрата удерживать одну молекулу воды
Н2О Û CaSO4 Û Н2О
CaSO4 · 2H2O
CaSO4 Û H2O Û CaSO4
2CaSO4 · H2O
Следовательно, процесс дегидратации гипса на молекулярном уровне, базирующийся на теории водородной связи, начинается с протонной перегруппировки ОН-групп и заканчивается выходом газообразных молекул кристаллизационной воды в реакционный объем по вакансионному механизму диффузии. Вследствие удаления молекул воды из решетки гипса и накопления ион-радикалов О2– обеспечивается пресыщение зародышей кристаллизации твердой фазы по отношению к полугидрату и он выкристаллизовывается в твердой фазе.
Макрокинетика обезвоживания гипса является процессом многостадийным и состоит из подвода теплоты, собственно химической реакции и отвода продуктов из реакционной зоны, в свою очередь, включающий адсорбцию и десорбцию воды и ее диффузию через формирующуюся структуру полугидрата.
Макрокинетика дегидратации тонкомолотого гипса и в виде щебня существенно отличается. Так, скорость дегидратации порошкообразного продукта лимитируется скоростью химической реакции, т. е. лежит в кинетической области и может быть описана уравнением
a = 1 – e–kt,
где a - степень дегидратации гипса; е - основание натурального логарифма; t - текущее время дегидратации гипса.
Данное уравнение показывает, что дегидратация гипсового порошка в неизотермических условиях при атмосферном давлении развивается по закону «случайного зародышеобразования»: при воздействии температуры в любой точке объема материала существует одинаковая вероятность случайного возникновения зародышей полугидрата за определенный промежуток времени. Эта вероятность не зависит от распределения образовавшихся зародышей, поскольку остается неперекристаллизованный продукт, в котором в последующем образуются новые зародыши полугидрата по закону вероятности, и так до тех пор, пока все кристаллы CaSO4 · 2H2O не вступят в реакцию.
Это можно проиллюстрировать следующим графиком (рис. 1.5), на котором показано, что в любой момент времени продукт дегидратации не является монофазным, т. е. состоящим только из одной модификации. Этот вывод вытекает из вышеприведенного уравнения, т. к. экспонента может достичь прямой, равной a = 1, только при бесконечно большом времени дегидратации гипса.
|

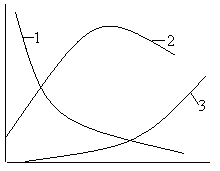
Рис. 1.5. Кинетика образования модификаций гипса:
1 - CaSO4 · 2H2O; 2 - CaSO4 · 0,5H2O; 3 - CaSO4
При дегидратации гипсового щебня макрокинетика процесса будет существенно иной, поскольку лимитирующей стадией будет являться не зарождение центров кристаллизации, а скорость роста кристаллов, что может быть описано уравнением
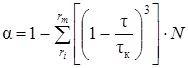 ,
,
где rm, ri - граничные размеры щебня; tк - конечное время дегидратации щебня данного размера; N - доля фракции данного размера.
Из этого уравнения видно, что качество продукта дегидратации зависит от времени обжига гипса, доли и крупности щебня.
Таким образом, макрокинетика процесса кристаллизации полугидрата включает следующие стадии. Зародыши кристаллов полугидрата объединяются по границам зерен, после чего они начинают расти, образуя сплошную поверхность раздела твердых фаз. Вследствие уменьшения при этом мольного объема гипса сильно возрастает внутренняя поверхность дегидратированного продукта (до 14 м2/г). Образующиеся поры в структуре полугидрата можно условно разделить на три вида: мезопоры r = (25–160) Å, микропоры r < (0,1–1,6) · 104 Å и макропоры r = (1–25)4 Å. Наибольшая доля пор припадает на микропоры.
1.4.3. Механизм процесса дегидратации CaSO4 · 2H2O.
Процесс дегидратации зависит в значительной мере от условий его проведения. При дегидратации гипса в аппаратах, сообщающихся с атмосферой, вода удаляется в виде пара. В закрытых аппаратах под повышенным давлением, когда среда насыщенна водяным паром, вода удаляется из гипса в капельно-жидком состоянии.
Удаление кристаллизационной воды из частиц CaSO4 · 2H2O в виде пара приводит к их диспергированию, продукт приобретает повышенную подвижность и образует в реакторе псевдоожиженный «кипящий» слой. В ходе такой термообработки структура образующихся кристаллов b - CaSO4 · 0,5H2O становится рыхлой, а сами кристаллы приобретают игольчатое строение и ориентированы к оси С под углом 60°. При этом размер и форма кристаллов полугидрата сохраняются такими, какими были у CaSO4 · 2H2O. Это является одной из причин получения гипсового вяжущего различной прочности, если размер и форма кристаллов исходного дигидрата сульфата кальция существенно отличаются. Отсюда вытекает важный вывод о том, что получение синтетического гипса может быть ориентировано на получение кристаллов заданного габитуса, а следовательно, высоких прочностных свойств гипсового вяжущего.
Удаляемая кристаллизационная вода образует поры как между отдельными кристаллами, так и внутри их. Именно поэтому b - CaSO4 · 0,5H2O имеет удельную поверхность в 2-2,5 раза большую по сравнению с a - CaSO4 · 0,5H2O.
В случае удаления кристаллизационной воды в капельно жидком состоянии образуется a - CaSO4 · 0,5H2O. Такое явление происходит в замкнутом пространстве или при кипячении гипсового порошка в растворах солей и кислот - NaCl, MgSO4, HNO3. При этом кристаллы полугидрата не разрыхляются и приобретают призматическую форму. Игольчатые кристаллы a - CaSO4 · 0,5H2O образуются лишь на плоскости [001] кристаллов гипса и растут только по оси С. В дальнейшем происходит перекристаллизация a-полугидрата, приводящая к увеличению толщины кристаллов. Формирование требуемого размера и формы кристаллов a - CaSO4 · 0,5H2O облегчается при введении в реакционный объем специальных добавок (жидкое стекло, лигносульфонаты кальция и др.).
Обе модификации полугидрата сульфата кальция близки по строению кристаллов (табл. 1.16), но существенно отличаются свойствами. Эта разница обусловлена, как уже отмечалось выше, отличием удельной поверхности вяжущих, а следовательно, разной водопотребностью при затворении.
Таблица 1.16
Дата добавления: 2015-06-17; просмотров: 2302;
