Термические уравнения состояния для идеального газа
Формально идеальный газ можно определить как газ, подчиняющийся уравнению Клапейрона: 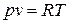 .
.
С физической точки зрения идеальный газ – это газ, молекулы которого лишены пространственной протяженности (объем молекул газа в сосуде – Vмол<<Vсосуда), а силы межмолекулярного взаимодействия практически отсутствуют, т.е. потенциальная энергия взаимодействия пренебрежимо мала по сравнению с энергией теплового движения молекул:
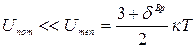 ,
,
где к=1,380658(12)×10-23 [Дж/К] – постоянная Больцмана; 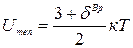 – закон равнораспределения энергии по степеням свободы молекул.
– закон равнораспределения энергии по степеням свободы молекул.
1. Для 1 кг: pv=RT, где R, Дж/кгК – удельная газовая постоянная, зависящая от рода газа; р, Па; v, м3/кг; Т, К.
2. Для m кг: pV=mRT, где V=mv, м3;
3. Для 1 моля: 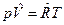 , где
, где 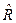 =8,31441, Дж/мольК – молярная газовая постоянная, одинаковая для всех газов,
=8,31441, Дж/мольК – молярная газовая постоянная, одинаковая для всех газов, 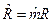 ;
; 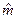 =М‧10-3, кг/моль – молярная масса,
=М‧10-3, кг/моль – молярная масса, 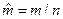 ;
; 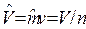 , м3/моль – молярный объем; n, моль – количество вещества.
, м3/моль – молярный объем; n, моль – количество вещества.
4. Для n молей: 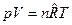 .
.
5. Для 1м3: 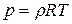 , где
, где 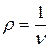 , кг/м3. В таком виде уравнение состояния используется в аэродинамике.
, кг/м3. В таком виде уравнение состояния используется в аэродинамике.
6. Для 1м3: 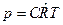 , где
, где 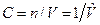 , моль/м3 – молярная концентрация. В таком виде уравнение состояния используется в химии.
, моль/м3 – молярная концентрация. В таком виде уравнение состояния используется в химии.
Дата добавления: 2015-06-12; просмотров: 1230;
