Состояние термодинамической системы. Параметры и функции состояния.
Состояние рассматриваемой ТС определяется совокупностью физических величин, характеризующих данную ТС. По изменениям этих величин можно проследить за изменениями в ТС при ее взаимодействии с окружающей средой.
Состояние ТС является равновесным, если в ТС наблюдается равномерное распределение физических величин. Так, для простой ТС во всех ее точках должны быть одинаковыми температура и давление. Если в ТС идут процессы выравнивания неравномерностей физических величин, то состояние системы является неравновесным. Состояние ТС изменяется в результате обмена энергией и массой между ТС и окружающей средой.
Параметрами и функциями состояния ТС называют физические величины, значения которых не зависят от пути, по которому ТС пришла в данное состояние, т.е. от предыстории ТС. К параметрам состояния относятся величины, которые имеют простую физическую природу и могут быть непосредственно измерены: температура Т, давление р, плотность r и удельный объем v. Эти параметры выражают интенсивные свойства. Функции состояния имеют сложную физическую природу и не могут быть непосредственно измерены. К ним относятся: внутренняя энергия U, энтальпия Н, энтропия S и другие величины.
На ТС при взаимодействии ее с окружающей средой действуют термодинамические силы, которые называются потенциалами термодинамических воздействий или обобщенными силами. К ним относятся механические силы: давление р [Па], касательное напряжение рt [Па], сила F [Н] и обобщенные силы немеханического характера: температура Т [К], напряженность магнитного поля Н [А/м], напряженность электрического поля Е [В/м].
Каждой обобщенной силе соответствует обобщенная координата. Обобщенными координатами называются параметры состояния, изменяющиеся при наличии взаимодействия данного рода. Так для простой ТС обобщенной силе – давлению р соответствует обобщенная координата – объем v, поскольку перемещение поршня приводит к изменению объема ТС. Для обобщенной силы – температуры Т роль обобщенной координаты выполняет энтропия S [Дж/К].
Различие значений обобщенной силы на границе между ТС и окружающей средой приводит к взаимодействию данного рода, т.е. к передаче энергии в данной форме. Это необходимое условие возникновения в ТС различных процессов: теплообмена и различных видов работ.
Все физические величины, характеризирующие ТС, подразделяются на независимые, которые задаются, и зависимые, которые вычисляются через известные параметры, а также на калорические и термические, интенсивные и экстенсивные, полные и относительные.
Калорические величины – это величины, которые выражаются в единицах энергии. Например: внутренняя энергия U[Дж], энтропия S[Дж/К], теплота Q [Дж], работа L [Дж], теплоемкость С [Дж/К] и др. Термические величины – это величины, чей физический смысл не связан непосредственно с понятием энергии. Например: термодинамическая температура Т [К], давление р [Па] и др.
Параметры, не зависящие от количества вещества ТС, выражают интенсивные свойства ТС. К ним относится:
1. термодинамическая температура Т,[К] (абсолютная термодинамическая шкала температур Кельвина), которая связана с эмпирической шкалой температур Цельсия t,0С (стоградусная международная температурная шкала) формулой:
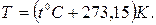
Абсолютная термодинамическая шкала температур определяется с помощью тройной точки воды в качестве реперной точки со значением 273,15К, а нижней границей шкалы служит абсолютный нуль температур.
Эмпирической температурой называется мера отклонения тела от состояния теплового равновесия с тающим льдом, находящимся под давлением в 1 физическую атмосферу. Измеряется эта температура термометрами: ртутным, спиртовым, газовым и др. На термометре наносят исходные опорные точки-реперы, отвечающие устойчивым тепловым состоянием: таяния льда (00С) и кипения воды (1000С) при р=1 физ.атм.
Эмпирическая шкала температур Фаренгейта имеет реперную точку при температуре тающей смеси равных долей льда и нашатырного спирта, которая принимается за 00F. Эта точка лежит на 320 F ниже 00С, а интервал от 00С до 1000С соответствует 1800F. Таким образом, шкала Цельсия связана со шкалой Фаренгейта формулой:
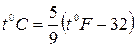 .
.
Цена деления шкалы Реомюра больше, чем шкалы Цельсия, т.к. интервал от 00С до 1000С разбит на 80 частей.
2. Термодинамическое абсолютное давление:
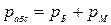 ,
, 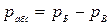 , [Па]
, [Па]
где рМ - манометрическое (избыточное) давление, измеряемое манометром; рБ – барометрическое (атмосферное) давление, измеряемое барометром; рВ – давление, измеряемое вакуумметром (избыток барометрического давления над абсолютным давлением).
Давление газа р численно равно силе, действующей на единицу площади поверхности и направленной по нормали к стенкам оболочки, в которой заключен газ. В системе СИ давление измеряется в Ньютонах на м2 или Паскалях, т.е. 1Н/м2=1Па. Связь с другими системами единиц:
1техн.атм = 0,968физ.атм = 9,81×104Па = 1кгс/см2 = 104кгс/м2 = 735ммНg =
= 10000,3ммН2О = 0,981бар.
3. Удельный объем рабочего тела v=V/m, м3/кг, где V, м3– объем ТС; m, кг – масса ТС.
4. Плотность – масса единицы объема рабочего тела, или массовая концентрация:
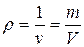 , кг/м3.
, кг/м3.
К параметрам, выражающим интенсивные свойства ТС относятся также напряженности электрического и магнитного полей и др.
Экстенсивными или аддитивными (суммируемыми) называются величины, значения которых пропорциональны количеству вещества ТС. Будем их обозначать прописными (заглавными) буквами. К ним относятся: внутренняя энергия U, энтальпия H, объем V, энтропия S и др. Эти величины называются также полными для m кг ТС.
Если ТС состоит из отдельных частей, то значение экстенсивной величины для ТС равно сумме значений этой величины для всех частей ТС.
Для гомогенной, однородной ТС удобно использовать относительные величины:
1. Удельные величины, отнесенные к 1 кг вещества. Например: v=V/m – удельный объем, м3/кг; h=H/m – удельная энтальпия, Дж/кг; u=U/m - удельная внутренняя энергия, Дж/кг; s=S/m – удельная энтропия, Дж/кгК и др.
2. объемные величины, отнесенные к 1м3 вещества: 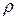 - массовая концентрация, кг/м3 и др.
- массовая концентрация, кг/м3 и др.
3. Молярные величины, отнесенные к 1 молю вещества. Будем обозначать эти величины прописными (заглавными) буквами со знаком «Ù» сверху буквы: 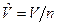 - молярный объем, м3/моль, где n – количество вещества, моль;
- молярный объем, м3/моль, где n – количество вещества, моль; 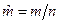 - молярная масса, кг/моль;
- молярная масса, кг/моль; 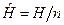 - молярная энтальпия, Дж/моль;
- молярная энтальпия, Дж/моль; 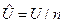 - молярная внутренняя энергия, Дж/моль;
- молярная внутренняя энергия, Дж/моль; 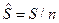 - молярная энтропия, Дж/(мольК) и др.
- молярная энтропия, Дж/(мольК) и др.
Молем газа называется количество газа, весящего столько граммов, сколько единиц в относительной молекулярной массе М:
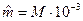 кг/моль.
кг/моль.
Напомним, что в одном моле любого вещества содержится NА=6,022×1023, моль-1, частиц (молекул) газа, где NA – число (постоянная) Авагадро. В соответствии с законом Авагадро в равных объемах разных газов при одинаковых давлении и температуре содержится равное число молекул. Массы молей разных газов различны, но их молярные объемы при одинаковых физических условиях одинаковы, т.е. не зависят от природы газа.
При t=00C и 1физ.атм 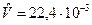 м3/моль,
м3/моль,
при t=150С и 1техн.атм 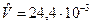 м3/моль.
м3/моль.
Для характеристики масс частиц вещества будем использовать величины:
1. Молекулярная масса – масса одной структурной частицы – m1, кг.
2. Относительная молекулярная масса 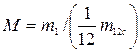 .
.
М – величина безразмерная и приводится в таблицах для каждого индивидуального вещества в справочниках.
3. Молярная масса – масса одного моля данного вещества 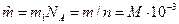 , кг/моль, где NA – число Авагадро.
, кг/моль, где NA – число Авагадро.
Дата добавления: 2015-06-12; просмотров: 1184;
