РАДИОНУКЛИДНЫЙ МЕТОД ИССЛЕДОВАНИЯ
Наше проникновение в мир атомов можно сравнить с великими, паяными открытий кругосветными путешествиями и дерзкими исследованиями астрономов, проникших в глубины мирового пространства.
Нильс Бор
Удручающе длинной казалась дистанция между физическими лабораториями, где ученые регистрировали треки ядерных частиц, и будничной клинической практикой. Сама мысль о возможности использования ядерно-физических феноменов для обследования больных могла показаться если не сумасбродной, то сказочной. Однако именно такая идея родилась в опытах венгерского ученого Д.Хевеши, впоследствии лауреата Нобелевской премии. В один из осенних дней 1912 г. Э. Резерфорд показал ему груду хлорида свинца, валявшуюся в подвале лаборатории, и сказал: «Вот, займитесь этой кучей. Постарайтесь из соли свинца выделить радий D».
После множества опытов, проведенных Д.Хевеши совместно с австрийским химиком А.Панетом, стало ясно, что химическим способом разделить свинец и радий D невозможно, так как это не отдельные элементы, а изотопы одного элемента — свинца! Они различаются только тем, что один из них радиоактивный. Распадаясь, он испускает ионизирующее излучение. Значит, радиоактивный изотоп — радионуклид — можно применять как метку при изучении поведения его нерадиоактивного близнеца.
Перед врачами открылись заманчивые перспективы: вводя в организм больного радионуклиды, наблюдать за их местонахождением с помощью радиометрических приборов. За сравнительно короткий срок радионуклид-ная диагностика превратилась в самостоятельную медицинскую дисциплину. За рубежом радионуклидную диагностику в сочетании с лечебным применением радионуклидов называют ядерной медициной.
Радионуклидный метод — это способ исследования функционального и морфологического состояния органов и систем с помощью радионуклидов и меченных ими индикаторов. Эти индикаторы — их называют радиофармацевтическими препаратами (РФП) — вводят в организм больного, а затем с помощью различных приборов определяют скорость и характер перемещения, фиксации и выведения их из органов и тканей.
Кроме того, для радиометрии могут быть использованы кусочки тканей, кровь и выделения больного. Несмотря на введение ничтожно малых количеств индикатора (сотые и тысячные доли микрограмма), не оказывающих влияния на нормальное течение жизненных процессов, метод обладает исключительно высокой чувствительностью.
Радиофармацевтическим препаратом называют разрешенное для введения человеку с диагностической целью химическое соединение, в молекуле которого содержится радионуклид. Радионуклид должен обладать спектром излучения определенной энергии, обусловливать минимальную лучевую нагрузку и отражать состояние исследуемого органа.
В связи с этим РФП выбирают с учетом его фармакодинамических (поведение в организме) и ядерно-физических свойств. Фармакодинамику РФП определяет то химическое соединение, на основе которого он синтезирован. Возможности же регистрации РФП зависят от типа распада радионуклида, которым он помечен.
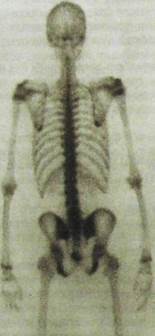
Выбирая РФП для исследования, врач должен прежде всего учесть его физиологическую направленность и фармакодинамику. Рассмотрим это на примере введения РФП в кровь. После инъекции в вену РФП первоначально равномерно распределяется в крови и транспортируется по всем органам и тканям. Если врача интересуют гемодинамика и кровенаполнение органов, то он выберет индикатор, который длительное время циркулирует в кровеносном русле, не выходя за пределы стенок сосудов в окружающие ткани (например, альбумин человеческой сыворотки). При исследовании печени врач предпочтет химическое соединение, которое избирательно улавливается этим органом. Некоторые вещества захватываются из крови почками и выделяются с мочой, поэтому они служат для исследования почек и мочевых путей. Отдельные РФП тропны к костной ткани, в связи с чем они незаменимы при исследовании костно-суставного аппарата (рис. 11.27). Изучая сроки транспортировки и характер распределения и выведения РФП из организма, врач судит о функциональном состоянии и структурно-топографических особенностях этих органов.
Однако недостаточно учитывать лишь фармакодинамику РФП. Нужно обязательно принимать во внимание ядерно-физические свойства входящего в его состав радионуклида. Прежде всего он должен иметь определенный спектр излучения. Для получения изображения органов применяют только радионуклиды, испускающие у-лучи или характеристическое рентгеновское излучение, так как эти излучения можно регистрировать при наружной детекции. Чем больше у-квантов или рентгеновских квантов образуется при радиоактивном распаде, тем эффективнее данный РФП в диагностическом отношении. В то же время радионуклид должен испускать по возможности меньше корпускулярного излучения — электронов, которые поглощаются в теле пациента и не участвуют в получении изображения органов. С этих позиций предпочтительны радионуклиды с ядерным превращением по типу изомерного перехода — 99mTc, lI3mIn.
Радионуклиды, период полураспада которых — несколько десятков дней, принято считать долгоживущими, несколько дней — среднеживущими, несколько часов — короткоживущими, несколько минут — ультракоротко-живущими. По понятным соображениям стремятся использовать короткожи-вущие радионуклиды. Применение среднеживущих и тем более долгоживу-
|
щих радионуклидов связано с повышенной лучевой нагрузкой, использование ультракороткожи-вуших радионуклидов затруднено по техническим причинам.
Существует несколько способов получения радионуклидов. Часть из них образуется в реакторах (Щ, 32Р> шХе, ,251), часть — в ускорителях (67Ga, 1П1п, I23I, IS0, "С, I3N). Однако наиболее распространенным способом получения радионуклидов является генераторный, т.е. изготовление радионуклидов непосредственно в лаборатории радионуклидной диагностики с помощью генераторов. Таким образом получают самый распространенный радионуклид — 99пТс, а также 133ш1п.
Очень важный параметр радионуклида — энергия квантов электромагнитного излучения. Кванты очень низких энергий задерживаются в тканях и, следовательно, не попадают на детектор радиометрического прибора. Кванты же очень высоких энергий частично пролетают детектор насквозь, поэтому эффективность их регистрации также невысока. Оптимальным диапазоном энергии квантов в радионуклидной диагностике считают 70-200 кэВ.

|
| "\, |
| Pic.П.27. Сцинтиграммы скелета после введения остеотропного РФП. |
Важным требованием к РФПявляется минимальная лучевая нагрузка при его введении. Известно, что активность примененного радионуклида уменьшается вследствие действия двух факторов: распада его атомов, т.е. физического процесса, и выведения его из организма — биологического процесса. Время распада половины атомов радионуклида называют физическим периодом полувыведения (Т^. Время, за которое активность препарата, введенного в организм, снижается наполовину за счет его выведения, именуют периодам биологического полувыведения. Время, в течение которого активность введен-108
ного в организм РФП уменьшается наполовину вследствие физического распада и выведения, называют эффективным периодом полувыведения (7UA
Для радионуклидных диагностических исследований стремятся выбрать РФП с наименее продолжительным Т^. Это и понятно: ведь от данного параметра зависит лучевая нагрузка на больного. Однако очень короткий физический период полураспада также неудобен: нужно успеть доставить РФП в лабораторию и провести исследование. Общее же правило таково: Т«фф препарата должен приближаться к продолжительности диагностической процедуры.
Как уже отмечалось, в настоящее время в лабораториях чаще используют генераторный способ получения радионуклидов, причем в 90—95 % случаев — это радионуклид МтТс, которым метят подавляющее большинство РФП. Кроме радиоактивного технеция, иногда применяют ,3Ч, ,33Хе, ^Оа, очень редко — другие радионуклиды.
Ниже приведены РФП, наиболее часто используемые в клинической практике.
РФП
| Wn.Jc. 99тТ-, WmTc- 99mTc-шХе 67Ga-Тс-«9-Тс 20IT1J |
альбумин
меченные эритроциты коллоид (технифит) бутил-ИДА (бромезида) пирофосфат (технифор) МАА
цитрат
сестамиби
моноклональные антитела
хлорид
Tc-DMSA (технемек)
ш1-гиппуран Tc-DTPA (пентатех) •*Tc-MAG-3 (технемаг) Тс-пертехнетат
,8F-DG ,MI-MIBG
Область применения
Исследование кровотока
Исследование кровотока
Исследование печени
Исследование желчевыделительной системы
Исследование скелета
Исследование легких
Исследование легких
ТуморотропныЙ препарат, исследование сердца
Туморотропный препарат
ТуморотропныЙ препарат
Исследование сердца, головного мозга, туморотропный препарат
Исследование почек
Исследование почек
Исследование почек и сосудов
Исследование почек
Исследование щитовидной железы и слюнных желез
Исследование головного мозга и сердца
Исследование надпочечников

|
Однажды во время своего обучения в Гвттингене Нильс Бор плохо подготовился к коллоквиуму и его выступление оказалось слабым. Однако Бор не пал духом и в заключение с улыбкой сказал: «Я выслушал здесь столь плохие выступления, что прошу рассматривать мое нынешнее как месть».
(Физики шутят.— М.: Мир, 1966)
Для выполнения радионуклидных исследований разработаны разнообразные диагностические приборы. Независимо от их конкретного назначения все эти приборы устроены по единому принципу: в них есть де-

|
тектор, преобразующий ионизирующее излучение в электрические импульсы, блок электронной обработки и блок представления данных. Многие радиодиагностические приборы оснащены компьютерами и микропроцессорами,
| Рис. П.28. Детектор с колодезным кристаллом йодида натрия. 1 — счетная пробирка; 2 — радиоактивная проба; 3 — коллиматор. ФЭУ — фотоэлектронный умножитель. |
В качестве детектора обычно используют сцинтилляторы или, реже, газовые счетчики. Сцинтиллятор — это вещество, в котором под действием быстро заряженных частиц или фотонов возникают световые вспышки — сцинтилляции. Эти сцинтилляции улавливаются фотоэлектронными умножителями (ФЭУ), которые превращают световые вспышки в электрические сигналы. Сиинтилляцион-ный кристалл и ФЭУ помещают в защитный металлический кожух — коллиматор, ограничивающий «поле видения» кристалла размерами органа или изучаемой части тела пациента.
Обычно у радиодиагностического прибора имеется несколько сменных коллиматоров, которые подбирает врач в зависимости от задач исследования. В коллиматоре имеется одно большое или несколько мелких отверстий, через которые радиоактивное излучение проникает в детектор. В принципе, чем больше отверстие в коллиматоре, тем выше чувствительность детектора, т.е. его способность регистрировать ионизирующее излучение, но одновременно ниже его разрешающая способность, т.е. свойство раздельно различать мелкие источники излучения. В современных коллиматорах имеется несколько десятков мелких отверстий, положение которых выбрано с учетом оптимального «видения» объекта исследования! В приборах, предназначенных для определения радиоактивности биологических проб, применяют сцинтилляционные детекторы в виде так называемых колодезных счетчиков (рис. 11.28). Внутри кристалла имеется цилиндрический канал, в который помещают пробирку с исследуемым материалом. Такое устройство детектора значительно повышает его способность улавливать слабые излучения биологических проб. Для измерения радиоактивности биологических жидкостей, содержащих радионуклиды с мягким р-излучением, применяют жидкие сцинтилляторы.
Все радионуклидные диагностические исследования делят на две большие группы: исследования, при которых РФП вводят в организм пациента,— исследования in vivo, и исследования крови, кусочков ткани и выделений больного — исследования in vitro.
При выполнении любого исследования in vivo требуется психологическая подготовка пациента. Ему необходимо разъяснить цель процедуры, ее значение для диагностики, порядок проведения. Особенно важно под-
черкнуть безопасность исследования. В специальной подготовке, как правило, нет необходимости. Следует лишь предупредить пациента о его поведении во время исследования. При исследованиях in vivo применяют различные способы введения РФП в зависимости от задач процедуры. В большинстве методик предусматривается проведение инъекции РФП, преимущественно в вену, гораздо реже в артерию, паренхиму органа, другие ткани. РФП применяют также перорально и путем вдыхания (ингаляция).
Показания к радионуклидному исследованию определяет лечащий врач после консультации с радиологом. Как правило, его проводят после других клинических, лабораторных и неинвазивных лучевых процедур, когда становится ясна необходимость радионуклидных данных о функции и морфологии того или иного органа.
Противопоказаний к радионуклидной диагностике нет, имеются лишь ограничения, предусмотренные инструкциями Министерства здравоохранения Российской Федерации.
Среди радионуклидных методов различают: методы радионуклидной визуализации, радиографию, клиническую и лабораторную радиометрию.
Термин «визуализация* образован от английского слова vision (зрение). Им обозначают получение изображения, в данном случае с помощью радиоактивных нуклидов. Радионуклидной визуализация — это создание картины пространственного распределения РФП в органах и тканях при введении его в организм пациента. Основным методом радионуклидной визуализации является гаммасцинтиграфия (или просто сцинтиграфия), которую проводят на аппарате, называемом гамма-камерой. Вариантом сцинтиграфии, выполняемой на специальной гамма-камере (с подвижным детектором), является послойная рад иону кл ид -ная визуализация — однофотонная эмиссионная томография. Редко, главным образом из-за технической сложности получения ультрако-роткоживущих позитронизлучающих радионуклидов, проводят двухфо-тонную эмиссионную томографию также на специальной гамма-камере. Иногда применяют уже устаревший метод радионуклидной визуализации — сканирование; его выполняют на аппарате, называемом сканером.
Сцинтиграфия — это получение изображения органов и тканей пациента посредством регистрации на гамма-камере излучения, испускаемого инкорпорированным радионуклидом.
Физиологической сущностью сцинтиграфии является органотроп-ность РФП, т.е. способность его избирательно аккумулироваться в определенном органе — накапливаться, выделяться или проходить по нему в виде компактного радиоактивного болюса.
Гамма-камера (рис. 11.29) представляет собой сложное техническое устройство, насыщенное микроэлектроникой и компьютерной техникой. В качестве детектора радиоактивных излучений применяют сцинтилляци-онный кристалл (обычно йодид натрия) больших размеров — диаметром до 50 см. Это обеспечивает регистрацию излучения одномоментно над

Pic. И.29. Гамма-камера «Эльсцинт».
всей исследуемой частью тела. Исходящие из органа гамма-кванты вызывают в кристалле световые вспышки. Эти вспышки регистрируются несколькими ФЭУ, которые равномерно расположены над поверхностью кристалла. Электрические импульсы из ФЭУ через усилитель и дискриминатор передаются в блок анализатора, который формирует сигнал на экране дисплея. При этом координаты светящейся на экране точки точно соответствуют координатам световой вспышки в сцинтилляторе и, следо-
вательно, расположению радионуклида в органе. Одновременно с помощью электроники анализируется момент возникновения каждой сцинтилляции, что дает возможность определить время прохождения радионуклида по органу.
Важнейшей составной частью гамма-камеры, безусловно, является специализированный компьютер, который позволяет производить разнообразную компьютерную обработку изображения: выделять на нем заслуживающие внимания поля — так называемые зоны интереса — и проводить в них различные процедуры: измерение радиоактивности (общей и локальной), определение размеров органа или его частей, изучение скорости прохождения РФП в этом поле. С помощью компьютера можно улучшить качество изображения, выделить на нем интересующие детали, например питающие орган сосуды.
При анализе сцинтиграмм широко применяют математические методы, системный анализ, камерное моделирование физиологических и патологических процессов. Естественно, все полученные данные не только отображаются на дисплее, но также могут быть перенесены на магнитные носители, переданы по компьютерным сетям.
Заключительным этапом сцинтиграфии обычно является создание твердой копии изображения на бумаге (с помощью принтера) или пленке (посредством фотокамеры).
В принципе каждая сцинтиграмма в той или иной степени характеризует функцию органа, так как РФП накапливается (и выделяется) преимущественно в нормальных и активно функционирующих клетках, поэтому сцинтиграмма — это функционально-анатомическое изображение. В этом уникальность радионуклидных изображений, отличающая их от получаемых при рентгенологическом и ультразвуковом исследованиях, магнитно-резонансной томографии. Отсюда вытекает и основное условие для назначения сцинтиграфии — исследуемый орган обязательно должен быть хотя бы в ограниченной степени функционально активным. В противном случае сцинтиграфическое изображение не получится. Вот почему бессмысленно назначать радионуклидное исследование печени при печеночной коме.
Сцинтиграфию широко применяют практически во всех разделах клинической медицины: терапии, хирургии, онкологии, кардиологии, эндокринологии и др.— там, где необходимо «функциональное изображение» органа. В том случае, если выполняют один снимок, то это статическая сцинтиграфия. Если же задачей радионуклидного исследования является изучение функции органа, то выполняют серию сцинтиграмм с различными временными интервалами, которые могут измеряться в минутах или секундах. Такую серийную сцинтиграфию называют динамической. Проанализировав на компьютере полученную серию сцинтиграмм, выбрав в качестве «зоны интереса» весь орган или его часть, можно получить на дисплее кривую, отображающую прохождение РФП через этот орган (или его часть). Такие кривые, построенные на основании результатов компьютерного анализа серии сцинтиграмм, именуют гистограммами. Они предназначены для изучения функции органа (или его части). Важным достоинством
гистограмм является возможность обрабатывать их на компьютере: сглаживать, выделять отдельные составляющие части, суммировать и вычитать, оцифровывать и подвергать математическому анализу.
При анализе сцинтиграмм, в основном статических, наряду с топографией органа, его размерами и формой определяют степень однородности его изображения. Участки с повышенным накоплением РФП называют горячими очагами, или горячими умами (рис. 11.30). Обычно им соответствуют избыточно активно функционирующие участки органа — воспалительно измененные ткани, некоторые виды опухолей, зоны гиперплазии. Вели же на сшттиграмме выявляется область пониженного накопления РФП, то, значит, речь идет о каком-то объемном образовании, заместившем нормально функционирующую паренхиму органа,— так называемые холодные узлы (рис 11.31). Они наблюдаются при кистах, метастазах, очаговом склерозе, некоторых опухолях.
Синтезированы РФП, избирательно накапливающиеся в опухолевой ткани,— туморотропные РФП, которые включаются преимущественно в клетки, обладающие высокой митотической и метаболической активностью. Вследствие повышенной концентрации РФП опухоль будет вырисовываться на сцинтиграмме в виде горячего очага. Такую методику исследования называют позитивной сцинтиграфией. Для нее создан ряд РФП (см. ранее).
Сцинтиграфия с мечеными моноклональными антителами носит название иммуносцинтиграфии.
Разновидностью сцинтиграфии является бинуклидное исследование, т.е. получение двух сцинтиграфических изображений с использованием одновременно вводимых РФП. Такое исследование проводят, например, для более отчетливого выделения мелких паращитовидных желез на фоне более массивной ткани щитовидной железы. С этой целью одновременно вводят два РФП, один из которых — ^'П-хлорид — накапливается в обоих органах, другой — ""Тс-пертехнетат — только в щитовидной железе. Затем с помощью дискриминатора и компьютера из первого (суммарного) изображения вычитают второе, т.е. выполняют процедуру субтракции, в результате чего получают итоговое изолированное изображение паращитовидных желез.
Существует особый тип гамма-камер, предназначенный для визуализации всего тела пациента. При этом датчик камеры перемещается над обследуемым пациентом (или, наоборот, пациент перемещается под датчиком). Получающаяся при этом сцинтиграмма будет содержать информацию о распределении РФП во всем теле больного. Таким путем получают, например, изображение всего скелета, выявляя при этом скрытые метастазы.
Для исследования сократительной функции сердца применяют гамма-камеры, снабженные специальным устройством — триггером, который под управлением электрокардиографа включает сцинтилляционный детектор камеры в строго заданные фазы сердечного цикла — систолу и диастолу. В результате этого после компьютерного анализа полученной информации на экране дисплея появляются два изображения сердца — систолическое и диастолическое. Совместив их на дисплее, можно изучить сократительную функцию сердца.
| & |
| i mm |
Ш/ Ш
i
A#|| 1 пиши iiiii ||(i hiu i ir I
| IF |
"Я
WW,
>s^
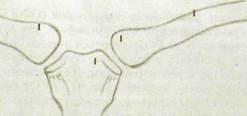
Рис. П.ЗО.Сканограмма щитовидной железы, В правой доле определяется зона повышенного накопления РФП — «горячий» очаг.

Рис.11.31. Сцинтиграмма легких. Отсутствие РФП в верхней зоне левого легкого.

|
Среднее время,которое ученыйотдает работе
Среднее время жизни человека— 60 лет Детство (школа, колледж, университет)— 24 года Сон (8 часов в сутки; сон во время научных дискуссий, лекций и семинаров не учитывается)— 20 лет
Отпуск (плюс выходные дни и праздники, 73 дня в год)— 12 лет Рдй(1 час в день)— 2,5 года Прочие потребности (0,5 ч в день)—1,5 года
Итог о... — 59,75 года
Чистое рабочее время — 0,25 года, т.е. около 90 дней. Ученый в среднем работает 1,5 дня в год или, если исключить детство,— 2,5 дня в год.
(Физики продолжают шутить.-' М.: Мир, 1968)
 Однофотпонная эмиссионная томография (ОФЭТ) постепенно вытесняет обычную статическую сцинтиграфию, так как позволяет с таким же количеством того же РФП добиться лучшего пространственного разрешения, т.е. выявлять значительно более мелкие участки поражения органа — горячие и холодные узлы. Для выполнения ОФЭТ применяют специальные гамма-камеры (рис. 11.32). От обычных они отличаются тем, что детекторы (чаще два) камеры вращаются вокруг тела больного. В процессе вращения сцинтилляционные сигналы поступают на компьютер из разных ракурсов съемки, что дает возможность построить на экране дисплея послойное изображение органа (как при другой послойной визуализации — рентгеновской компьютерной томографии).
Однофотпонная эмиссионная томография (ОФЭТ) постепенно вытесняет обычную статическую сцинтиграфию, так как позволяет с таким же количеством того же РФП добиться лучшего пространственного разрешения, т.е. выявлять значительно более мелкие участки поражения органа — горячие и холодные узлы. Для выполнения ОФЭТ применяют специальные гамма-камеры (рис. 11.32). От обычных они отличаются тем, что детекторы (чаще два) камеры вращаются вокруг тела больного. В процессе вращения сцинтилляционные сигналы поступают на компьютер из разных ракурсов съемки, что дает возможность построить на экране дисплея послойное изображение органа (как при другой послойной визуализации — рентгеновской компьютерной томографии).
ОФЭТ предназначена для тех же целей, что и статическая сцинтигра-фия, т.е. для получения анатомо-функционального изображения органа, но отличается от последней более высоким качеством изображения. Она позволяет выявить более мелкие детали и, следовательно, распознать заболевание на более ранних стадиях и с большей достоверностью. При наличии достаточного числа поперечных «срезов», полученных за короткий период времени, с помощью компьютера можно построить на экране дисплея трехмерное объемное изображение органа, позволяющее получить более точное представление о его структуре и функции (рис. 11.33).
Существует еще один вид послойной радионуклидной визуализации — позитронная двухфотонная эмиссионная томография (ПЭТ). В качестве РФП используют радионуклиды, испускающие позитроны, в основном ультракороткоживущие нуклиды, период полураспада которых составляет несколько минут,— "С (20,4 мин), ,3N (10 мин), »Ю (2,03 мин), I8F (НО мин). Испускаемые этими радионуклидами позитроны аннигилируют вблизи атомов с электронами, следствием чего является возникновение двух гамма-квантов — фотонов (отсюда и название метода), разлетающихся из точки аннигиляции в строго противоположных направлениях. Разлетающиеся кванты регистрируются несколькими детекторами гамма-камеры, располагающимися вокруг обследуемого.
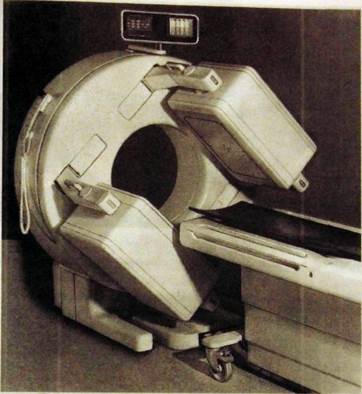
Рис. П.32. Ротационная гамма-камера для эмиссионной томографии.
Основным достоинством ПЭТ является то, что используемыми при ней радионуклидами можно метить очень важные в физиологическом отношении лекарственные препараты, например глюкозу, которая, как известно, активно участвует во многих метаболических процессах. При введении в организм пациента меченой глюкозы она активно включается в тканевый обмен головного мозга и сердечной мышцы. Регистрируя с помощью ПЭТ поведение этого препарата в названных органах, можно судить о характере метаболических процессов в тканях. В головном мозге, например, таким образом выявляют ранние формы нарушения кровообращения или развития опухолей и даже обнаруживают изменение физиологической активности мозговой ткани в ответ на действие физиологических раздражителей — света и звука (рис. 11.34). В сердечной мышце определяют начальные проявления нарушения метаболизма.
Распространение этого важного и весьма перспективного метода в клинике сдерживается тем обстоятельством, что ультракороткоживущие радионуклиды производят на ускорителях ядерных частиц — циклотронах. Ясно, что работать с ними можно только в том случае, если циклотрон расположен непосредственно в лечебном учреждении, что, по понятным причи-
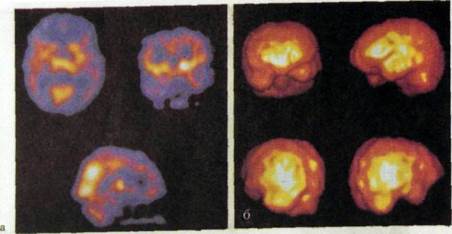
Рис. П.ЗЗ. Эмиссионная томография головного мозга.
а - томограммы в трех проекциях; б - объемная реконструкция изображения
мозга.
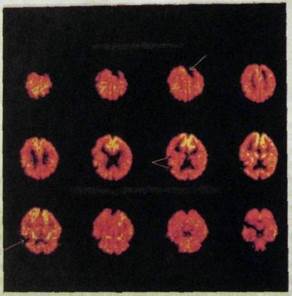
Рис. 11.34. Серия томограмм (позитронная двухфотонная эмиссионная томография). Очаги инфаркта в головном мозге (указаны стрелками).
нам, доступно лишь ограниченному числу медицинских центров, в основном крупным научно-исследовательским институтам.
Сканирование предназначено для тех же целей, что и сцинтиграфия, т.е. для получения радионуклидного изображения. Однако в детекторе сканера имеется сцинтилляционный кристалл сравнительно небольших размеров,
несколько сантиметров в диаметре, поэтому для обозрения всего исследуемого органа приходится перемещать этот кристалл последовательно строка за строкой (например, как электронный пучок в электронно-лучевой трубке). Движения эти медленные, вследствие чего продолжительность исследования составляет десятки минут, иногда 1 ч и более. Качество получаемого при этом изображения низкое, а оценка функции - лишь приблизительная. По этим причинам сканирование в радионуклидной диагностике применяют редко, в основном там, где отсутствуют гамма-камеры.
Для регистрации функциональных процессов в органах — накопления, выведения или прохождения по ним РФП — в некоторых лабораториях применяют радиографию. Радиограф имеет один или несколько сцинтилляционных датчиков, которые устанавливают над поверхностью тела пациента. При введении в организм больного РФП эти датчики улавливают гамма-излучение радионуклида и преобразуют его в электрический сигнал, который затем записывается на диаграммной бумаге в виде кривых.
Однако простота устройства радиографа и всего исследования в целом перечеркивается весьма существенным недостатком — низкой точностью исследования. Дело в том, что при радиографии в отличие от сцинтиграфии очень трудно соблюсти правильную «геометрию счета», т.е. расположить детектор точно над поверхностью исследуемого органа. В результате подобной неточности детектор радиографа часто «видит» не то, что нужно, и эффективность исследования оказывается низкой.
Под клинической радиометрией понимают измерение радиоактивности всего тела или его части после введения в организм РФП. Обычно в клинической практике используют гамма-излучающие радионуклиды. После введения в организм РФП, содержащего такой радионуклид, его излучения улавливаются сцинтилляционным детектором, расположенным над соответствующей частью тела пациента. Результаты исследования обычно представляются на световом табло в виде количества импульсов, зарегистрированных за определенный промежуток времени, либо в виде скорости счета (в импульсах в минуту). В клинической практике данный метод не имеет большого значения. Обычно его используют в тех случаях, когда необходимо выявить и оценить инкорпорацию радионуклидов при случайном их попадании в организм человека — пб неосторожности, при катастрофах.
Более интересный метод — радиометрия всего тела. При ее проведении человека помещают в специальную низкофоновую камеру, содержащую несколько специально ориентированных сцинтилляционных детекторов. Это позволяет регистрировать радиоактивное излучение всего тела, причем в условиях минимального влияния естественного радиоактивного фона, который, как известно, в некоторых областях поверхности Земли может быть весьма высоким. Если во время выполнения радиометрии закрыть свинцовой пластиной какую-либо часть тела (орган), то можно оценить вклад именно этой части тела (или располагающегося под пластинкой органа) в общую радиоактивность организма. Таким путем удается изучить метаболизм белков, витаминов, железа, определить объем внеклеточной воды. Этот метод применяют также при обследовании людей со случайной инкорпорацией радионуклидов (вместо обычной клинической радиометрии).

рис. 11.35. Аппаратура для радиоиммунологического анализа.
Для лабораторной радиометрии используют автоматизированные радиометры (счетчики проб; рис. 11.35). В них на конвейере располагаются пробирки с радиоактивным материалом. Под управлением микропроцессора пробирки автоматически подаются к окну колодезного счетчика; после выполнения радиометрии происходит автоматическая смена пробирок. Результаты измерения подсчитываются в компьютере, и после соответствующей обработки они поступают на печатающее устройство. В современных радиометрах в автоматическом режиме производятся сложные расчеты, и врач получает готовую информацию, например о концентрации в крови гормонов и ферментов с указанием точности выполненных измерений. Если объем работы по лабораторной радиометрии невелик, то применяют более простые радиометры с ручным перемещением пробирок и выполнением радиометрии вручную, в неавтоматическом режиме.
Радионуклидная диагностика in vitro (от лат. vitrum — стекло, поскольку все исследования проводят в пробирках) относится к микроанализу и занимает пограничное положение между радиологией и клинической биохимией. Она позволяет обнаружить присутствие в биологических жидкостях (кровь, моча) различных веществ эндогенного и экзогенного происхождения, находящихся там в ничтожно малых или, как говорят химики, исчезающих концентрациях. К таким веществам относятся гормоны, ферменты, лекарственные препараты, введенные в организм с лечебной целью, и др.
При различных заболеваниях, например при раке или инфаркте миокарда, в организме появляются вещества, специфические для этих заболеваний, их называют маркерами (от англ. mark — метка). Концентрация маркеров столь же ничтожно мала, как и гормонов: буквально единичные молекулы в 1 мл крови.
Все эти уникальные по своей точности исследования могут быть выполнены с применением радиоиммунологического анализа, разработанного в 1960 г. американскими исследователями С. Берсоном и Р. Ялоу, которым впоследствии за эту работу была присуждена Нобелевская премия. Широкое внедрение его в клиническую практику ознаменовало собою революционный скачок в микроанализе и радионуклидной диагностике. Впервые врачи получили возможность, причем весьма реальную, расшифровывать механизмы развития многих заболеваний и диагностировать их на самых ранних стадиях. Наиболее зримо ощутили значение нового метода эндокринологи, терапевты, акушеры, педиатры1.
Принцип радиоиммунологического метода состоит в конкурентном связывании искомых стабильных и аналогичных им меченых веществ со специфической воспринимающей системой.
Для выполнения такого анализа выпускают стандартные наборы реагентов, каждый из которых предназначен для определения концентрации какого-либо одного конкретного вещества.
Схема радиоиммунологического исследования представлена на рис. 11.36. Как видно на рисунке, связывающая система (чаще всего это специфические антитела или антисыворотка) вступает во взаимодействие одновременно с двумя антигенами, один из которых искомый, другой — его меченый аналог. В качестве метки по ряду соображений наиболее часто используют гамма-излучатель ,251, реже — бета-излучатель 3Н. Применяют растворы, в которых меченого антигена содержится всегда больше, чем антител. В этом случае разыгрывается настоящая борьба меченого и немеченого антигенов за связь с антителами. Последние относятся к иммуноглобулинам класса G.
Они должны быть узкоспецифическими, т.е. реагировать только с исследуемым антигеном. Антитела акцептируют на своих открытых связывающих местах (сайтах) лишь специфичные для них антигены, причем в количествах, пропорциональных количеству антигенов. Этот механизм образно описывают как феномен «замка и ключа»: чем больше исходное содержание искомого антигена в реагирующих растворах, тем меньше радиоактивного аналога антигена будет захвачено связывающей системой и тем большая его часть останется несвязанной.
Одновременно с определением концентрации искомого вещества в крови пациента в тех же условиях и с теми же реагентами проводят исследование стандартных сывороток с точно установленной концентрацией искомого антигена. По соотношению радиоактивностей прореагировавших компонентов строят калибровочную кривую, отражающую зависимость радиоактивности пробы от концентрации исследуемого вещества. Затем, сопоставляя радиоактивность проб материала, полученного от пациента, с калибровочной кривой, определяют концентрацию искомого вещества в пробе.
• Подробнее см.: Гринин А.С., Рыбаков С.С. Радиоиммунологический анализ.— М.: Энергоатомиздат, 1984; Ткачева ГЛ., Балабоякин М.И., Ларичева #//• Радиоиммунологические методы исследования.— М.: Медицина, 1983; Нард /. Радиоиммунологический анализ: Пер. с англ.— М.: Мир, 1981.
| „Свободная радиоактивность" (не прореагировавшие вещества) |
| „Связанная радиоант явность' (прореагировавшие! вещества) |
 Исследуемое вещество
Исследуемое вещество
Меченый аналог исследуемого вещества
Л

|
0.
Концентрация
Рис. 11.36. Схема выполнения радиоиммунологического анализа.
Радионуклидный анализ in vitro стали называть радиоиммунологическим, поскольку он основан на использовании иммунологических реакций антиген—антитело. Однако в дальнейшем были созданы другие близкие по целям и методике» но различающиеся по деталям виды исследования in vitro. Так, если в качестве меченой субстанции применяют антитело, а не антиген, анализ называют иммунорадиометрическим; если же в качестве связывающей системы взяты тканевые рецепторы, говорят о радиореиепторном анализе.
Радионуклидное исследование в пробирке состоит из 4 этапов (рис. 11.37).
Первый этап — смешивание анализируемой биологической пробы с реагентами из набора, содержащего антисыворотку (антитела) и связывающую систему. Все манипуляции с растворами проводят специальными полуавтоматическими микропипетками, в некоторых лабораториях их осуществляют с помощью автоматов.
Второй этой — инкубация смеси. Она продолжается до достижения динамического равновесия: в зависимости от специфичности антигена ее
 Рис. 11.37. Этапы радиоиммунологического анализа.
Рис. 11.37. Этапы радиоиммунологического анализа.
Дата добавления: 2015-06-12; просмотров: 5730;
