Ашықтықтар (нм) және бұрыштар
Полипептидті тізбектің құрылысының ерекшелігі оның арқасында орналасқан көміртегімен азот атомдары шамамен бір жазықтыкта орналасқан, ал сутегі атомы мен радикал осы жазықтыққа 109,28° бұрышпен бағытталған. Сонымен, көршілес амин қышкыл калдығындағы сутегі атомы мен радикалдың орналасуы қарама-карсы. Екінші бір полипептидтік тізбек құрылысындағы ерекшелік —СО-NН- байланысының өзгешелігінде. Бұл топтағы көміртегі мен азот арасыңдағы байланыс өзінің ара қашықтығы жағынан қос байланысқа жаќын (0,132 нм), дара байланыс –С– N- (0,149 нм), қос байланыс С = N (0,127 нм). Міне осы жағдай белоктар мен полипептидтердің қасиетіне әсер етеді.
Полипептидтік тізбектің тағы бір ерекше қасиеті біртектес — NН- СО- фрагменттерден тұратын тізбек өзінің химиялық табиғаты жағынан єртектес бүйірлік топтармен коршалған. Бүйірлік топтар — радикалдар функциональдық жағынан алуан түрлі. Олардың көпшілігінің құрамында бос амин немесе карбоксил топтары, гидроксилді, фенолды, амидті тағы да басқа функционалды топтар бар. Белоктың көптеген қасиеттері, єсіресе олардың кеңістікте орналасуы осы радикалдармен анықталады. Сонымен қатар басқа факторлармен бірге бслоктың функционалды активтілігіне єсер етеді.
Сонымен амин қышқыл қалдықтары бір-бірімен пептидтік байланыс арқылы байланыса отырып пептидтер, не белоктар түзеді. Әдетте, пептидтер құрамында 20-ға дейін амин қышқыл қалдықтары болса, онда оларды олигопептидтер деп, ал құрамында амин қышқылдары 50-ге дейін болса онда олар полипептидтер, ал 50-ден астам амин қышқылы бар жєне молекулалық салмағы 6 мыңнан жоғары болса, ондай полипептидтерді белоктарға жатқызады. Молекулалық массасы ең төмен белок инсулин гормоны ол 51 амин қышқылдарының қалдықтарынан тұрады. Белок молекуласының құрамындағы амин қышқылдары жоғарыда көрсетілгендей. Белоктың молекулалық салмағы бірнеше жүздеген, тіптен мындаған болуы мүмкін. Табиғатта белок түрлері өте көп, олардың бір-бірінен айырмашылығы құрамындағы амин қышқылдарының єртүрлілігіне, ягни олардың саны, сапасы және реттеліп орналасуына байланысты. Мысалы үш амин қышқылынан 6 түрлі үш пептид (трипептид) алуға болады, ал төрт амин қышқылдарынан 24-тетрапептидтер алуға болады.
Басқа органикалық қосылыстар тєрізді пептидтер химиялық реакцияларға түсе алады, бұл олардың құрамындағы бос амин және карбоксил топтарына ғана емес, сонымен қатар бүйірлік (радикал) топтарына да байланысты. Осы реакциялардың ішінде ерекше екі реакцияны айтуға болады. Бірінші пептидтерді қышқылдармен немесе сілтілермен ыдырату нєтижесінде бос аминқышқылдары бөлінеді.
Екінші бір маңызды реакция пептидтердің динитрофтор-бензолмен реакцияға түсуі. Бұл қосылыс пептидтердің бос a-амин тобымен байланысып динитрофенилпептид түзеді. Осы реакцияны белоктар мен пептидтердің құрамындағы амин қышқылдарының реттеліп орналасуын N-соңынан бастап анықтауға пайдаланады.
Тірі ағзада бос күйінде пептидтер кездеседі, олардың көпшілігі биологиялық активті. Мысалы, гормондардың кейбіреулері химиялық табиғаты жағынан пептидтер. Ал гормондар ішкі секреция бездерінің маманданған жасушаларынан бөлініп қан арқылы басқа мүшелер мен ұлпарға тасымалданып, олардың өздеріне тєн атқаратын қызметін тєртіпке келтіреді. Кейбір улы заттарда пептидтерге жатады, саңырауқүлақтардағы аминтин деген улы зат, сонымен қатар көптеген антибиотиктерде-пептидтер.
№4 дәріс
Тақырыбы: Белок молекуласының құрылымдары
Жоспар: 1.Белоктың бірінші деңгейдегі құрылымы
2. Белоктың екінші деңгейдегі құрылымы
3. Белоктың үшінші деңгейдегі құрылымы
4. Белоктың төртінші деңгейдегі құрылымы
Белок молекуласының төрт деңгейлі қүрылымы жөніндегі түсінікті ең біріші үсынған Ландерстром-Ланг. Белок молекуласының құрылымы басқа биополимерлерге қарағанда єлдеқайда күрделі. Сонымен белок молекуласының төрт деңгейдегі құрылымдық ұйымдасуы болады. Олар: бірінші, екінші, үшінші, төртінші деңгейдегі құрылымдар.
Белоктың бірінші деңгейдегі құрылымы.Белок молекуласының бірінші деңгейдегі құрылымы полипептидтік тізбектегі амин қышқылдарының реттеліп орналасуы. Бірінші деңгейдегі құрылымға тән пептидтік байланыс ұзындығы 0,132 нм, бұл –С– N- байланысынан (0,149 нм)
С = N қос байланысынан ұзын (0,127 нм). Кейбір ғалымдар пептидтік байланысты ішінара қос байланыс, ішінара дара байланыс деген пікір айтуда. Л.Полинг пен Р.Кори рентген құрылымдақ анализ әдісінмен пептидтік байланыс бұрышын анықтап, полипептидтік тізбек бір жазықтықта орналасқанын дәлелдеді. Дара байланыстардың бұралу бұрыщтары торсионды деп аталады да N – Сα бұрышы φ, ал С – Сα бұрышы – ψ деп белгіленеді. Әр амин қышқылының өзіне тән бұралу бұрышы болады, бұл белоктардың екінші құрылымын сипаттайды. Пептидтік тізбектегі орынбасушы топтар пептидтік байланысқа цис- немесе транс- жағдайында болуы мүмкін, және де транс- жағдайдағы пептидтік байланыс мықтырақ келеді де табиғи белоктарда (полипептидтерде) көп таралған, ал цис- пептидтік байланыстар сиректеу кездеседі және көбінесе оны пролин қалдықтары түзеді.
Соңғы жылдары белоктар биохимиясыныцң дамуының арқасында белоктардың бірінші құрылымы туралы мәліметтер жинақталуда, қазіргі кезде 14-тен астам белоктардың бірінші құрылымы белгілі болды.
| Белок аттары | Молекулалық салмағы | Амин қышқылдарының саны |
| Клупин | ||
| Инсулин | ||
| Цитохром С | ||
| Рибонуклеаза | ||
| Гемоглобин | ||
| α -тізбек | ||
| β-тізбек | ||
| γ-тізбек | ||
| Миоглобин | ||
| Папаин | ||
| Трипсин | ||
| Трипсиноген | ||
| Химотрипсиноген | ||
| Пепсин | ||
| Т.б. |
Белок молекуласында бір немесе бірнеше тізбек болуы мүмкін, мысалы рибонуклеазада 1 тізбек, инсулинде – 2, гемоглобинде – 4, т.б.
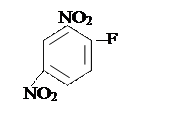
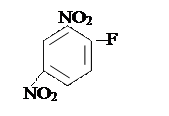
Полипептидтік тізбектің екі соңы бар. Бос NH2-тобы бар шетін N - соңы деп, ал бос СООН тобы бар шетін С – соңы деп белгілейді. Әдетте тізбектің басын N соңынан бастайды. Ең бірінші рет өткен ғасырдың 50-ші жылдарында инсулин деген гормонның бірінші деңгейдегі құрылымын анықтаған ағылшын биохимигі Ф.Сенгер болды. Ол белокты 1-фтор-2,4-динитробензолмен (ДНФБ) өңдегенде бұл реагент белоктың бос NH2 — тобымен байланысын сары түсті полипептидтік 2,4 — динитро-фенилді туындысын түзеді. Осы қосылысты қышқылмен өңдегеңде оның құрамындағы барлық пептидтік байланыстар үзіледі, бірақ ДНФБ-мен N-соңғы амин қышқылының арасындағы коваленттік байланыс өзгеріссіз қалады. N-соңғы амин қышқылы ерітіндіде 2,4-динитрофенил туындысы түрінде болады, ал белок молекуласының құрамындағы басқа амин қышқылдары жеке-жеке бөлініп кетеді. ДНФБ мен байланысқан ең бастапқы N-соңғы амин қышқылын хроматографикалық әдісті пайдалана отырып оңай анықтауға болады:
 R1 R2
R1 R2
│ │
+NH2–CH–CO–HN–CH–CO–HN– –COOH –––→
белок (полипептид)
ДНФБ
 |
R1 R2
│ │H2O PH<7
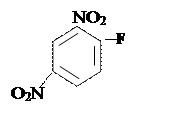
+NH2–CH–CO–HN–CH–CO–HN– –COOH +HF ––––––→
гидролиз
 |
R1 R2
│ │
+NH2–CH–COOH+(H2N–CH–COOH)n-1
2,4- ДНФ-аминқышқылы бос аминқышқылдары
Белок молекуласының N -соңындағы амин қышқылын анықтайтын тағы бір әдіс Эдман ұсынған фенилтиоционат әдісі. Бұл әдіс бойынша белокқа фенилтиоцианатпен (Эдман реактиві) әсер етеді.
C6H5 – N = C + H2N – CH– CO – HN – CH– CO – HN – – – COOH –––→
║ │ │
S R1 R2
C6H5 – NH – C – HN – CH– CO – HN – CH – CO – HN – – – COOH
║ │ │
S R1 R2
Түзілген аралық қосылысқа сусыз хлорлы сутегімен әсер еткенде N соңғы амин қышқылы Эдман реактивімен байланысқан күйінде белоктың молекуласынан бөлініп сақиланады да фенилтиотидантоин түзеді. Оның қандай амин қышқылы екенін хроматографиялык, әдіс арқылы анықтауға болады. Бұл әдістің бір артықшылығы қалған белок молекуласына осы әдісті қайта қолдана отырып екінші, үшінші т.б. орында тұрған N соңғы амин қышқылдарын біртіндеп анықтауға болады. Міне, осы принципке сүйене отырып белоктың немесе пептидтің құрамыңдағы амин қышқылдарының реттеліп орналасу тәртібін N шетінен бастап анықтайтын автоматты анализатор жасалынған. Осылардан басқа N шеткі амин қышқылын белокқа дансилхлорид реагентімен әсер ете отырып анықтауға болады. Белок молекуласының бос карбоксил тобы бар С-соңындағы амин қышқылын анықтайтында бірнеше әдістер бар. Солардың ішінде жапон ғалымы
С.Акобари ұсынған әдіс. Бұл жағдайда белок молекуласын гидрозинмен өндеп ыдыратады.
Нәтижесінде пептидтік байланыстар үзіліп, бөлініп шыққан әрбір амин қышқылдары гидрозинмен байланыса отырып амин қышқылдарының гидрозиді түзіледі. Тек ең соңғы С-шеткі амин қышқылы бос күйінде бөлінеді. Оны жоғарыда айтылғандай хроматографиялық әдіспен анықтайды.
H2N–CH–CO–HN–CH–CO–HN– – – – CO–HN–CH–COOH + NH2–NH2
│ │ │
R1 R2 Rx гидразин
––––––→(H2N–CH–CONHNH2)n-1 + RxCH–COOH
│ │
R NH2
амин қышқылдарының гидразиді бос аминқышқылдары
С-соңғы амин қышқылын карбоксипептидаза ферментімен әсер етіп бөліп алуға болады. Бұл фермент белок құрамындағы пептидтік байланысты тек бос СООН — тобы бар жағынан үзеді. Полипепидтен бөлінген С - шеткі амин қышқылын хромогографиялық әдісті қолдана отырып анықтауға болады. Белоктағы амин қышқылдарының орналасу тәртібін (бірінші деңгейдегі құрылымын) толық анықтау үшін алдымен ұзын полипептидтік тізбекті — белок молекуласын кішірек фрагменттерге бөлшектейді. Ол үшін белокты әртүрлі ферменттердің әсерімен немесе химиялық әдіспен қысқа пептидтерге ыдыратады да солардағы амин қышқылдарының орналасу тәртібін жоғарыда келтірілген әдістерді қолдана отырып анықтайды.
Бұл жерде көңіл аударатын жағдай әртүрлі ферменттер немесе химиялық реагенттер арнаулы амин қышқылы қалдықтарының арасындағы пептидтік байланыстарды үзеді. Міне осылай бірін-бірі бүркеп жататын фрагменттерді алып олардағы реттеліп орналасқан амин қышқылдарын айқындайды. Мысалы, белокты ыдыратудың нәтижесінде алынған пептидті фрагменттер

 Ала – Сер – Тир – Гли Асп – Вал – Тир – Цис
Ала – Сер – Тир – Гли Асп – Вал – Тир – Цис
а б
Тре – Мет – Тре – Лей Ала – Сер

 в г
в г
Тир – Гли – Асп – Вал Тир – Цис – Тре – Мет – Тре – Лей
 д е
д е
Осы алынған жеке пептидтерден амин қышқыл қалдықтарының орналасуын салыстырса, а-пептидте, г-пептидтегі және д-пептидтегі амин қышқылдарының бастапқы екеуі қайталанады. Осыдан полипепидтік тізбекте г-пептидтен кейін д-пептид одан кейін б-пептид одан әрі с-пептид орналасады. Міне осылай берілген полипептидтің бірінші деңгейдегі құрылымын толық анықтауға болады.
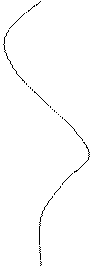
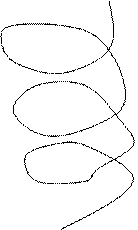
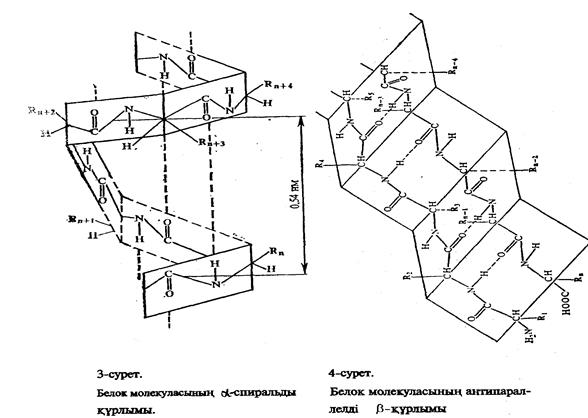
Белок молекуласының екінші деңгейдегі құрылымы сутектік байланыспен бекітіледі.Белок молекуласындағы полипептидтік тізбек ұзыннан ұзақ созылып жатқан түзу тізбек емес. Осындай түжырымға ғалымдар белоктың рентгенограммасын қарастыра отырып келген. Осы бағытта біраз зерттеулер жүргізген америка ғалымдары Л.Полинг пен Р.Кори. Олардың алға қойған мақсаты белоктағы полипептидтік тізбектің конформациясын, яғни кеңістікте орналасуын зерттеу болды. Алынған нәтежелерге сүйене отырып әрбір молекуланың үш өлшемді құрылымының барын айқындады, әсіресе маңыздысы пептидтік байланыстың құрылымын анықтау болды. Оның ерекшеліктеріне сүйене отырьш полипептидтік тізбектің шиыршықталып (спиральденіп) жинақталатынын көрсетті. Сөйтіп екінші деңгейдегі құрылымда полипептидік тізбек қайталанып отыратын оң a-спираль, b- құрылым, b-иіліс түрінде болатыны анықталды. Амин қышқылдар оң a-спираль түзеді. Осындай құрылым (a-спираль, b- құрылым) пептидтік байланыстағы – С - мен – N - топтарының
׀ ׀׀
O H
арасында түзілетін сутектік байланыс арқылы жүзеге асады
О- - - - - - - - - - - - - - - Н
ïï ï
С - (NН-СНR-СО)3 – N
Әрбір карбонил топ тізбектің бойында орналасқан төртінші NН— тобымен сутектік байланыс түзеді. Єрбір a - спиральдің бір айналымында 3,6 амин қышқылдарының қалдығы болады, спиральдың єр қадамы 0,54 нм. β - құрылымды да спираль деп қарастыруға болады, бірақ ондағы спираль созылған түрінде болады. Полипептидтік тізбектің қатпарланған бөлшектері (қүрылым) антипараллельді жєне параллельді болуы мүмкін. Егер, катпарланған тізбек кейін бұрылып өзіне-өзі паралель бағытталса оңда антипаралельді b - қүрылым түзіледі.
Полипептидтік тізбек бұрылған жерінде b-иіліс пайда болады. b-иіліске жүйелі, бір сутектік байланыспен бекітіледі, бір ізділікпен орналасқан төрт амин қышқылдары кіреді. Паралельді β- құрылым жинақталған кезде полипептидтік тізбектің кесінділері бір бағытта орналасады.
Қатпарланған қабаттар (b-қүрылым) бір полипептидтік тізбек бойында ғана емес, сонымен қатар молекулада бір-біріне жақын жатқан полипептидтік тізбектер тобының арасында да болады. Белок молекуласының спиральдену (шиыршықтану) деңгейі белоктардың түріне байланысты. Айталық, парамиозин деген белоктың спиральденуі 100% болса, гемоглобинде 75%, химотрипсиногенде небєрі 11% қана. β- құрылымда полипептидтік тізбек формасы созылған, зигзаг тәрізді болып келеді. Амин қышқылдар арасындағы қашықтық 0,35 нм, бұл a – спиральдегі қашықтықтан 3 есе үлкен. Амин қышқыл қалдығы бір b-қүрылым бойында екіге тең.
 Белок молекуласындағы a – спиральдің болуы әр белокта әр түрлі және әр белок макромолекуласына жеке ерекшелігі болып келеді. Мысалы, миоглобинде a – спираль құрылымының негізінде болады, ал химотрипсин молекуласы a – спиральденбеген.
Белок молекуласындағы a – спиральдің болуы әр белокта әр түрлі және әр белок макромолекуласына жеке ерекшелігі болып келеді. Мысалы, миоглобинде a – спираль құрылымының негізінде болады, ал химотрипсин молекуласы a – спиральденбеген.
Орта есеппен глобулярлы белоктарды a – спиральденуі 60-70% құрайды. Тізбек ішінде кездесетін a – спиральдену амин қышқылдарының табиғатына тәуелді. Мысалы, глутамин қышқылы молекулалары теріс зарядталған, бір-бірін жақындағанда тебініп сутектік байланыс түзілмейді, сол себепті a – спираль түзбейді.





 1,5нм
1,5нм

 •
•
 •
•
•
H C = O – H – N

 ׀
׀

 N
N
C Спиральдің 1 орамы =3,6
║ амин қышқылдарының
O қалдығына тең.
H (3,6х0,15)=0,54 нм.
 ׀ C N = H-O=C
׀ C N = H-O=C
 N ║
N ║
 O
O
• C
• ║
H O
׀ •
H • C = O – H - N
 •
•
 N = H – O = C
N = H – O = C
Белок молекуласы құрылымының нобайы. А-α-спираль, Б-β-құрылым, В-үш спиральді коллаген құрылымы.
Осындай себеппен зарядталған лизин мен аргинин молекулалары араларында a – спираль пайда болмайды. a – спиральдің түзілуіне кедергі келтіретін пролин амин қышқылы, себебі пролин амин қышқылы полипептидтік тізбек ішінде сутектік байланыс түзбейді, (пролинде азот атомы сақина түзуге қатысады) a – спиральдік құрылым бұзылады да β –құрылым пайда болады.
Белоктардың үшінші реттік құрылымы.Белоктың үшінші реттік құрылымы деп полипептидті тізбектің белгілі бір көлемде кеңістікте орналасуы. Үшінші реттік құрылымның формасына қарай, белоктарды глобулярлы және фибрилярлы түрлеріне бөледі.
Белок молекуласы пішініндегі иіліп бұралу, қат-қабат қатпарлар, қисық бұрылыстар негізінен төмендегідей әрекеттесуге байланысты:
1. Амин қышқылдары қалдықтары арасындағы сутектік байланыс.
2. Қарама-қарсы зарядтары бар бүйірлік топтардың өзара әрекеттесуінің электростатикалық күштері (лизин мен аргинин т.б.)
3. Амин қышқылдарындағы полярсыз радикалдар арасындағы гидрофобтық әрекеттесу. Белоктарда болатын амин қышқылдарының бүйірлі радикалдары судың әсерінен гидрофобтық ядро түзіп глобулярлы молекуланың ортасына орналасады, ал гидрофильдік радикалдар глобулярлы молекуланың сыртқы бетінен орын алады. Гидрофильдік радикалдардың сумен сутектік байланыстар түзуі арқылы гидраттық қабат береді. Гидрофобты ілінісу күші әлсіз байланыс, бірақ бірнеше рет қайталанып келетіндіктен барлығы қосылғанда едәуір әрекеттесу қуатын береді.
4. Белок молекуласындағы металл иондарының және амин қышқылдарындағы бүйірлік топтардың өзара әрекеттесуі. (Мысалы, цистин молекулалары арасындағы – S – S – дисульфидтік байланыстар).
Қорытындылап айтқанда әрбір белоктың үшінші реттік құрылымының ерекшелігі, полипептидтік тізбектің құрамына кіретін амин қышқылдарының орналасу ретіне (бірінші реттік құрылымына) және амин қышқылдарының сандық мөлшеріне тәуелді.
Белок молекуласының үш өлшемді құрылымы өз кезегіңде жаңа типті хабарды біріктіреді. Академик В.А.Энгельгард бұны интрамолекулярлы (хабар) деп атаған болатын. Белоктардың барлық биологиялық қасиеттері (каталиттік, гормондық, антигендік және т.б.) төменде көрсетілгендей, олардың үшінші реттік құрылымының сақталғандығымен байланысты, оны белоктың нативті конформациясы деп те атаймыз. Молекула конформациясының бұзылуына әкелетін кез-келген әсер (термиялық, физико-химиялық) белоктың биологиялық қасиетін аздап немесе толығымен жоюына әкеліп соғады.
Белок молекуласының төртінші деңгейдегі құрылымы . Төртінші деңгейдегі құрылым олигомерлі белоктарда болады . Мұндай белоктар екі немесе одан да көп полипептидтік тізбектерден тұрады. Құрамына кіретін полипептидтік тізбектер бірдей немесе әртүрлі болуы мүмкін. Жеке полипептидтік тізбектерді суббөліктер деп атайды. Суббөліктер (протомерлер) бірінші, екінші, үшінші деңгейдегі құрылымдармен сипатталады . Енді олардың бір-бірімен байланысып жинақталып, оралуы сол белоктың табиғи кеңістіктегі конформациясын, төртінші деңгейдегі құрылымын түзеді. Олигомерлі белоктардың молекулалық салмағы бір полипептидтік тізбекті белоктарға қарағанда әлдеқайда жоғары және олар күрделі қызмет атқарады. Төртінші деңгейдегі құрылымы бар олигомерлі белоктардың молекулалық салмағы 50000-астам болу керек. Өте танымал олигомерлі белок гемоглобин. Оның белоктық бөлігі екі бірдей ά-және екі бірдей β-тізбегінен тұратын
әрбір тізбектің үш деңгейде құрылымы болады. Осы төрт тізбек бір-біріне жақындап түйісіп шамамен тэтраэдр түрінде болады да гемоглобиннің төртінші деңгейдегі құрылымын түзіледі.
Жеке суббөліктердің бір-бірімен түйісіп байланысуында олардың құрамындағы белгілі аминқышқыл қалдықтарының радикал топтарының арасындағы байланыстардың маңызы зор болады.
Олар сутектік, электростатикалық, гидрофобтық т.б. әрекеттесулер. Көптеген ферменттер, күрделі белоктар төртінші деңгейдегі құрылыммен сипатталады.
Дата добавления: 2015-06-10; просмотров: 3774;
