Тізбек жазылдаы, бірақ коваленттік құрылымы бұзылмайды.
Табиғи қалпына келтіруге балады, мұны денатурация деп атайды. Мысалы денатурацияланған трипсин ферментін жайлап бөлме температурасына дейін суытса ол қайтадан өзінің каталитикалық қасиетіне ие болады.
Белок оптикалық активті зат, өзі арқылы өткен полярланған сәулені не оңға, не солға бұрады. Барлық белоктар ультракүлгін сәулені сіңіреді (190, 250, 280 нм толқын ұзындығында). Бұл қасиеті оның құрамыңдағы ароматты амин қышқылдарына (тирозин, фенилаланин, триптофан), белок молекуласындағы α-спиральдағы сутектік байланыстарға және белоктағы пептидтік байланыстарға тәуелді. Белоктың осы қасиетіне сүйене отырып, оның мөлшерін спектрофотометрлік әдіспен анықтауға болады.
Белок макромолекулалары қарапайым амин қышқылдарынан тұрады. Белоктарды түзетін амин қышқылдарының құрылысын мынадай түрде көрсетуге болады.
R – CH – COOH

NH2
Амин қышқылдары түрлі белок молекулаларын түзетін мономерлі жеке заттар. Адам ағзасында 70 жуық амин қышқылдары бар екені белгілі, бірақ олардың 20 ғана белок молекуласы құрамына кіреді. Бұлар протеиногенді амин қышқылдары.
Кейбір белоктардың құрамында жоғарыда көрсетілген амин қышқылдармен қатар аз мөлшерде минорлы амин қышқылдар болады.
Минорлы амин қышқылдары — радикалдарды түрлендірудің нәтижесінде пайда болған протеиногенді амин қышқылдарының туындылары. Минорлы амин қышқылдарына мысалретінде мына төмендегілерді келтіруге болады.
Аденилилтирозин
Ацетиллизин
Гидроксилизин
Гидроксипролин
Гликозиласпартат
Гликозилсерин
Гликозилтреонин
Гликозилгидроксилизин
Гликозилгидроксипролин
Десмозин и изодесмозин
(лизиннің туындысы) ,
Карбоксиглутамат
Метиларгинин
Метилгистидин
Метиллизин
Монойодтирозин
Дийодтирозин
Трийодтиронин
Тетрайодтиронин
Сульфотирозин
Фосфосерин
Фосфотреонин
Цистин
 Глициннен басқа амин қышқылдарына оптикалық активтілік тән. Протеиногенді амин қышқылдары тек L- формада ғана болады, бірақ тірі табиғатта D-амин қышқылдардың бар екені байқалады, олар ұзындығы қысқа пептидтер құрамында немесе бос жеке күйде болуы мүмкін.
Глициннен басқа амин қышқылдарына оптикалық активтілік тән. Протеиногенді амин қышқылдары тек L- формада ғана болады, бірақ тірі табиғатта D-амин қышқылдардың бар екені байқалады, олар ұзындығы қысқа пептидтер құрамында немесе бос жеке күйде болуы мүмкін.
Амин қышқылдары молекуласында карбоксильдік (- СООН) топ та, аминдік (- NH2) топ та бар. Амин қышқылдары молекуласында аминдік топ α,- β,- γ- жағдайында және басқа да түрінде болуы мүмкін. Табиғи белоктардан тек α-амин қышқылдары ғана табылған. Олардың биологиялық маңызы зор, себебі олардан белок молекулалары құралады. Амин қышқылдарының құрамында R-радикал бүйірдегі топтарды көрсетеді. Радикал құрамында ашық, жабықта тізбек және әр түрлі фуңкциялық топтар болуы мүмкін.
Амин қышқылдарының жіктелуі
Табиғатта кездесетін барлық амин қышқылдарға жалпы қасиет амфотерлік, яғни әрбір амин қышқылының құрамында кем дегенде бір қышқылдық бір негіздік топтарының болуымен сипатталады.
Жалпы формулада көрсетілгендей амин қышқылдары бір-бірінен R-радикалының химиялық табиғатымен ерекшеленеді. Барлық α -амин және α -карбоксил топтары белок молекуласындағы пептидті тізбек түзуге қатысады. Осы кезде олар өздерінің амин қышқылдарына еркін сәйкес қышқылды-негізді касиетін жоғалтады.
Сондықтан да белок молекулаларының құрылымының түрлі ерекшеліктері және қызметі оның химиялық табиғатына және амин қышқыл радикалдарының физико-химиялық қасиеттеріне байланысты. Осыған байланысты белоктар бірқатар өзіне негізделген ерекшеліктерімен және басқа биополимерлерге тән емес химиялық жекешелігімен ерекшеленеді. Баска принциптер ұсынылғанына қарамай, амин қышқылдарының радикалдарының химиялық құрылыс негізіне байланысты амин қышқылдарын бөледі. Амин қышқылдарын ароматты және алифатгы деп бөледі, сонымен қатар күкірт және гидроксил топтары бар амин қышқылдары деп атайды. Көбіне бөліну амин қышқылының зарядының табиғатына негізделген. Егер радикал нейтрал болса, онда олар нейтрал амин қышқылы деп аталады. Көбіне мұндай қышқылдарда бір амин, бір карбоксил тобы болады. Егер амин қышқылының құрамында амин немесе карбоксил топтары болса, онда олар сол қасиетке сәйкес кышқылды немесе негізді деп аталады. Амин қышқылдарының қазіргі рационалды бөлінуі радикал полярлығына негізделген, яғни олардың сумен әрекеттесу қабілетіне байланысты. Ол амин қышқылының 4 класын, біріктіреді:
1) полярсыз-гидрофобты,
2) полярлы-гидрофильді-зарядталмаған
3) теріс зарядталған,
4) оң зарядталған.
Протеиногенді амин қышқылдарын радикалдарының қалдығына байланысты 4-топқа бөледі.
І. Полярсыз радикалды аминоқышқылдар немесе полярсыз (гидрофобты)
аминоқышқылдар.
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH H2N–C–COOH
│ │ │ │
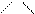 CH3 CH CH2 CH– CH 3
CH3 CH CH2 CH– CH 3
аланин (ала) │ │
CH3 CH3 CH CH2
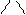 валин (вал) │
валин (вал) │
CH3 CH3 CH3
лейцин (лей) изолейцин (иле)
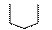 H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH HN–C–COOH
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH HN–C–COOH
│ │ │
CH2 CH2 CH2
 │ │ │ пролин (про)
│ │ │ пролин (про)
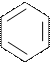 CH2
CH2
│
S–CH3 │
метионин (мет) NH фенилаланин (фен)
триптофан (три)
1. Зарядталмаған полярлы радикалды аминоқышқылдар немесе полярлы
(гидрофильді) зарядталмаған аминоқышқылдар.
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH H2N–CН–COOH
│ │ │
CH2OH CH–OH CH2
Глицын (гли) серин (сер) │ │
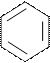 CH2
CH2
треонин (тре)
│
ОН
тирозин (тир)
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH
│ │ │
CH2SH CH2 CH2
цистейн (цис) │ │
O=C–NH2 CH2
аспарагин (асп) │
O=C–NH2
глутамин (глу)
2. Теріс зарядталған полярлы радикалды аминоқышқылдар немесе теріс
зарядталған (қышқылды) аминоқышқылдар.
H2N–CH–COOH H2N–CH–COOH
│ │
CH2 CH2
│ │
COOH CH2
аспартат (асп) │
COOH
глутамат (глу)
3. Оң зарядталған полярлы радикалды аминоқышқылдар немесе оң
зарядталған (негізді) аминоқышқылдар.
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH
│ │ │
(CH2)4 (CH2)3 CH2
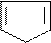 │ │ │
│ │ │
NH2 NH =C–NH2
лизин (лиз) аргинин (арг)
NH
гистидин (гис)
Амин қышқылдарының қышқылды-негізді қасиеттері белоктардың көптеген физико-химиялық және биологиялық 4 қасиеттерін анықтайды. Амин қышқылдарын бөлу және идентификациялау осы қасиеттерге негізделген. Амин қышқылдар суда тез ериді. Олар судың нейтрал ерітінділерінде, биполярлы ион (цвиттерион) формасында кристалданады. Барлық амин қышқылдары физиологиялық рН мәнінде цвиттерион құрылымында болады).
R R
׀ ׀
H – C – NH2 H – C – NH3+
׀ ׀
COOH COO¯ цвиттерион
Кристалды аминқышқылын еріткенде, мысалы: аланинді суда еріткенде ол қышқыл тәрізді (протон беруші донор)
NH3 – CH – COO¯ NH2 – CH – COOH
׀ ׀
CH3 CH3
немесе негіз сияқты (протон қосып алушы):
N+H3CH(CH3)COO¯ + H+ N+H3CH(CH3)COOH
Амин қышқылдарының амфотерлік ерекшелігі болғандықтан, олар күшті негіздермен де, күшті қышқылдармен де әрекеттесіп тұз түзеді:
R – CH – COOH + NaOH R – CH – COONa + H2O
׀ ׀
NH2 NH2
R – CH – COOH + HCl R – CH – COOH
׀ ׀
NH2 NH3Cl
рН белгілі мәнінде амин қышқылы молекуласының электрлік заряды нольге тең және ол изоэлектрлік нүктеден не анодка не катодка жылжымайды. рН-тың мұндай мәні изоэлектрлік нүкте деген ат алады және рI-деп белгіленеді.
Амин қышқылдарының изоэлектрлік нүктесі, қосымша қышқылды немесе сілтілік топтармен байланыспайтын, екі рК мәнінің арасындағы қосындының орта санына тең.
Белоктардың амин қышкылдық құрамын зерттеу үшін бірінші қышқылды (НСІ), сілтілі (NaОН) және жиірек ферментативті гидролизді пайдаланады.
Белоктың аминқышқылды құрамы XX гасырдың 30-шы жылдарында ғана анықталды.
1871 жылы Н.И.Любавин (орыс оқымыстысы) өзінің зерттеулерінде ас қорыту сөлі ферментінің әсерінен белоктардың аминқышқылына дейін ыдырайтынын анықтады. Осы жасалған тәжірибелер белок құрамын анықтауда басты роль атқарды. Осыдан кейін А.Данилевский мен Э.Фишер амин қышқылдарының бір-бірімен пептидті байланысып, тізбектесіп тұратынын айтты.
Осы екі зерттеулерден екі маңызды тұжырым жасалған: біріншіден - белок құрамына амин қышқылдары кіреді, ал екіншіден - гидролиз әдісімен белоктардың химиялық және амин қышқылды құрамы зерттеледі.
Таза белокты гидролиздегенде, егер оның ешқандай қоспасы болмаса, онда 20 түрлі α – амин қышқылдары бөлініп шығады. Басқа да көптеген өсімдіктер, микроағзалар, жануарлар ұлпасындағы амин қышқылдары табиғатта еркін түрде және қысқа пептид түрінде немесе басқа да органикалық заттармен қосылыс түрінде кездеседі.
Дата добавления: 2015-06-10; просмотров: 3256;
