Первичная структура пептидов и белков.
Первичная структура пептидов и белков - это аминокислотная последовательность, т.е. порядок чередования α-аминокислотных остатков, связанных пептидными связями (-СО-NН-).
Условно считают, что пептиды содержат в молекуле до 100 (что соответствует молекулярной массе до 10 тыс.), а белки - более 100 аминокислотных остатков (молекулярная масса от 10 тыс. до нескольких миллионов).
В свою очередь, в группе пептидов принято различать олигопептиды (низкомолекулярные пептиды), содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, в состав цепи которых входит до 100 аминокислотных остатков. Макромолекулы с числом аминокислотных остатков, приближающимся или немного превышающим 100, не разграничивают по понятиям полипептиды и белки, эти термины часто используют как синонимы.
Пептидную и белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с образованием пептидной (амидной) связи между мономерными звеньями (рис. 5).
Конструкция полиамидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся пептидных (амидных) групп -СО-NH- и фрагментов -CH(R)-.
Один конец цепи, на котором находится аминокислота со свободной группой NH2, называют N-концом, другой - С-концом, на котором находится аминокислота со свободной группой СООН. Пептидные и белковые цепи записывают с N-конца.
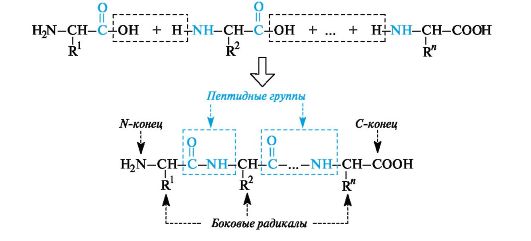
Рис. 5. Принцип построения пептидной цепи
6. Вторичная структура белков (α- спираль и β- складчатая структура); стабилизация в пространстве.
Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны и более высокие уровни организации, которые называют вторичной, третичной и четвертичной структурами.
Вторичная структура описывается пространственной ориентацией основной полипептидной цепи, третичная - трехмерной архитектурой всей белковой молекулы. Как вторичная, так и третичная структура связана с упорядоченным расположением макромолекулярной цепи в пространстве.
Расчетным путем было показано, что для полипептидной цепи одной из наиболее выгодных конформаций является расположение в пространстве в виде правозакрученной спирали, названной α-спиралью (рис. 6, а).
Пространственное расположение α-спирализованной полипептидной цепи можно представить, вообразив, что она обвивает некий цилиндр (см. рис. 6, б).
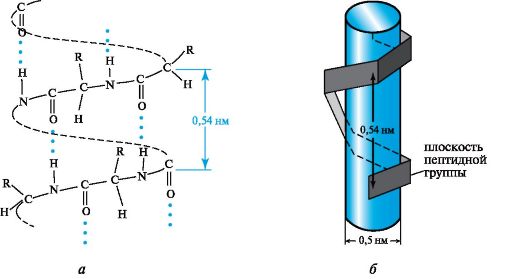
Рис. 6. α-Спиральная конформация полипептидной цепи
На один виток спирали в среднем приходится 3,6 аминокислотного остатка, шаг спирали составляет 0,54 нм, диаметр - 0,5 нм. Плоскости двух соседних пептидных групп располагаются при этом под углом 108°, а боковые радикалы аминокислот находятся на наружной стороне спирали, т.е. направлены как бы от поверхности цилиндра.
Основную роль в закреплении такой конформации цепи играют водородные связи, которые в α-спирали образуются между карбонильным атомом кислорода каждого первого и атомом водорода NН-группы каждого пятого аминокислотного остатка.
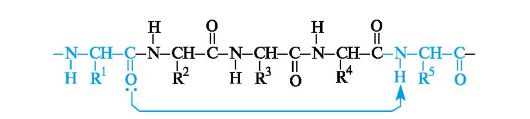
Водородные связи направлены почти параллельно оси α-спирали. Они удерживают цепь в закрученном состоянии.
Обычно белковые цепи спирализованы не полностью, а лишь частично. В таких белках, как миоглобин и гемоглобин, содержатся довольно длинные α-спиральные участки, например цепь миоглобина спирализована на 75%. Во многих других белках доля спиральных участков в цепи может быть небольшой.
Другим видом вторичной структуры полипептидов и белков является β-структура, называемая также складчатым листом, или складчатым слоем. В складчатые листы укладываются вытянутые полипептидные цепи, связываемые множеством водородных связей между пептидными группами этих цепей (рис. 7). Во многих белках одновременно содержатся α-спиральные и β-складчатые структуры.
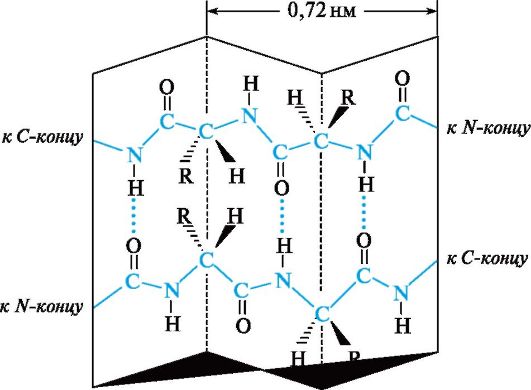
Рис. 7. Вторичная структура полипептидной цепи в виде складчатого листа (β-структура)
7. Третичная структура белков; взаимодействия, стабилизирующие третичную структуру.
Третичная структура белка определяет общее расположение его полипептидной цепи в пространстве. Полагают, что в формировании и стабилизации третичной структуры белковой молекулы решающая роль принадлежит взаимодействию боковых заместителей аминокислот, которые сближаются в пространстве за счет изгибов полипептидной цепи. Третичная структура стабилизируется за счет формирования водородных, ионных (солевых), гидрофобных связей и дисульфидных мостиков.
Третичная структура белковой молекулы возникает совершенно автоматически в результате самоорганизации полипептидной цепи в соответствии с ее первичной и вторичной структурами, а также с составом окружающего раствора. Движущей силой, свертывающей полипептидную цепь белка в строго определенное трехмерное образование, является взаимодействие аминокислотных радикалов между собой и с молекулами окружающего раствора. При этом в водных растворах гидрофобные заместители вталкиваются внутрь белковой молекулы, образуя там сухие зоны («жирные капли»), а гидрофильные - ориентируются в сторону водной среды. В некоторый момент достигается энергетически выгодная конформация молекулы для водной среды, и такая конформация белковой молекулы стабилизируется. При этом энтропия полипептидной цепи уменьшается, а энтропия системы в целом (полипептидная цепь + водная среда) остается постоянной или возрастает. Таким образом, с позиции II закона термодинамики стабилизацию третичной структуры белка в водной среде обеспечивает стремление водного окружения молекулы белка перейти в состояние с максимальной энтропией.
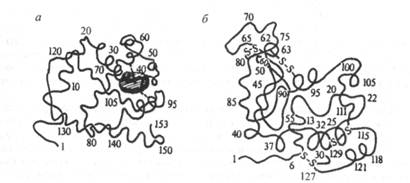
Рис. 8. Третичная структура миоглобина
Третичная структура белка, по сравнению с его вторичной структурой, еще более чувствительна к внешним воздействиям. Поэтому действие слабых окислителей, смена растворителей, изменения ионной силы, рН среды и температуры нарушают третичную структуру белков, а, следовательно, и их нативные свойства.
8. Особенности структуры коллагена, белков эмали и дентина.
Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови. На примере коллагенов и эластина рассмотрим особенности строения этих белков и связь их строения с функцией.
Дата добавления: 2015-05-26; просмотров: 11454;
