Определение аминокислотной последовательности в белке
Определение N-концевой аминокислоты в белке и последовательности аминокислот в олигопептидах
Фенилизотиоционат (ФИТЦ) - реагент, используемый для определения N-концевой аминокислоты в пептиде. Он способен реагировать с α-аминогруппой и α-карбоксильной группой свободных аминокислот, а также с N-концевой аминокислотой в пептидах (см. схему ниже).
В результате взаимодействия с N-концевой аминокислотой полипептида образуется фенил-тиогидантионовое производное, в котором дестабилизирована пептидная связь между α-карбоксильной группой N-концевой аминокислоты и α-аминогруппой второй аминокислоты в пептиде. Эта связь избирательно гидролизуется без повреждения других пептидных связей.
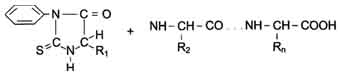
После реакции выделяют комплекс ФИТЦ-АК1, идентифицируют его хроматографическими методами. ФИТЦ можно использовать вновь с укороченным пептидом, полученным в предыдущем цикле, для определения следующей аминокислоты. Этот процесс ступенчатого расщепления пептида с N-конца был автоматизирован и реализован в приборе - секвенаторе, с помощью которого можно определять последовательность аминокислотных остатков в олигопептидах, состоящих из 10-20 аминокислот.
Многие полипептиды имеют первичную структуру, состоящую более чем из 100 аминокислот. Так как с помощью секвенаторов наиболее продуктивно определяют аминокислотную последовательность лишь небольших пептидов, молекулы полипептида расщепляют по специфическим местам на фрагменты.
Используя несколько разных расщепляющих агентов (ими могут быть ферменты или химические вещества) в разных пробах очищенного полипептида, можно получить частично перекрывающие друг друга фрагменты с установленной аминокислотной последовательностью. С их помощью можно воссоздать правильный порядок фрагментов и получить полную последовательность аминокислот в полипептидной цепи.
Ферментативное расщепление полипептида по специфическим участкам
Для специфического расщепления пептидных связей в белке можно использовать несколько разных ферментов. Наиболее широко используют ферментативный гидролиз полипептида протеолитическим ферментом - трипсином, который относят к группе пищеварительных ферментов (его вырабатывает поджелудочная железа). Фермент обладает высокой специфичностью действия. Он расщепляет пептидные связи, в образовании которых участвует карбоксильная группа остатков лизина или аргинина.
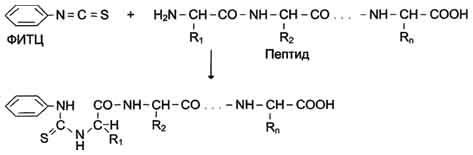
Исходя из установленного количества остатков лизина и аргинина, можно предсказать количество получаемых при гидролизе трипсином фрагментов. Так, если в полипептидной цепи 6 остатков аргинина и лизина, то при расщеплении трипсином можно получить 7 фрагментов. Затем в каждом фрагменте устанавливают аминокислотную последовательность.
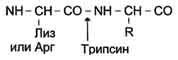
Схема
Химическое расщепление полипептида по специфическим участкам
В некоторых случаях предпочтителен не ферментативный, а химический гидролиз. Так, реагент бромциан расщепляет только пептидные связи, в которых карбоксильная группа принадлежит остатку метионина. Зная количество остатков метионина в полипептидной цепи, легко установить количество получаемых фрагментов. Далее для каждого фрагмента в секвенаторе также устанавливают аминокислотную последовательность.
Получение аминокислотной последовательности полипептида с помощью перекрывающихся фрагментов
Для успешного установления последовательности полученных фрагментов полипептида необходимо получить пептиды с перекрывающимися аминокислотными последовательностями. Это достигают обработкой отдельных проб данного полипептида разными реагентами, расщепляющими белок в разных местах. Необходимо провести столько расщеплений, чтобы получить набор пептидов, обеспечивающих перекрывание всех участков, необходимых для определения последовательности исходного полипептида.
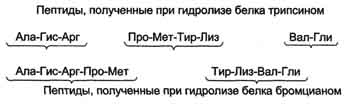
Рис. 4. Установление первичной структуры белка с помощью перекрывающихся пептидных фрагментов.
4. Отдельные представители пептидов: аспартам, глутатион.
Один из наиболее распространенных представителей трипептидов - глутатион - содержится в организме всех животных, в растениях и бактериях.
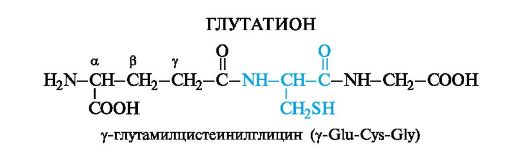
Цистеин в составе глутатиона обусловливает возможность существования глутатиона как в восстановленной, так и окисленной форме.
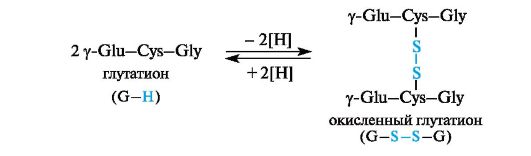
Глутатион участвует в ряде окислительно-восстановительных процессов. Он выполняет функцию протектора белков, т.е. вещества, предохраняющего белки со свободными тиольными группами SH от окисления с образованием дисульфидных связей -S-S-. Это касается тех белков, для которых такой процесс нежелателен. Глутатион в этих случаях принимает на себя действие окислителя и таким образом «защищает» белок. При окислении глутатиона происходит межмолекулярное сшивание двух трипептидных фрагментов за счет дисульфидной связи. Процесс обратим.
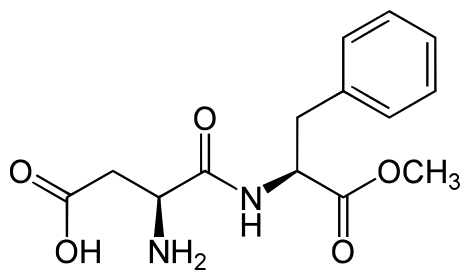
Аспартам - дипептид, состоящий из остатков L-аспарагиновой кислоты и метилового эфира L-фенилаланина, используется в качестве заменителя сахара – низкокалорийной пищевой добавки. Почти в 200 раз слаще сахарозы.
Дата добавления: 2015-05-26; просмотров: 7158;
