Белки дентина
Поскольку дентин является разновидностью соединительной ткани, то он содержит присущий этой ткани органический матрикс, сформированный коллагеновыми белками I, III, IV, V, VI типов, и протеогликанами, которые постоянно с разной скоростью синтезируются одонтобластами. Основной коллаген дентина, как и в костной ткани, относится к коллагену I типа. В дентине между коллагеновыми фибриллами расположены липидные гранулы (липосомоподобные структуры), и содержание липидов достигает 330-350 мг на 100 г ткани. Что касается других органических соединений, то их содержание довольно низкое.
Особое место среди неколлагеновых белков дентина занимают кислые фосфопротеины, богатые аспарагиновой кислотой и фосфосерином, что придаёт этим белкам способность связываться с кальцием. По сравнению с костной тканью в дентине значительно меньше белков, содержащих γ-карбоксиглутаминовую кислоту.
9. Физико-химические свойства белков: растворимость, ионизация, гидратация, денатурация и ренатурация.
Гидратация и растворимость белков. Большинство глобулярных белков относятся к гидрофильным веществам, хорошо растворяющимся в воде. Это свойство обусловлено расположенными на поверхности белка группами, способными гидратироваться. Под гидратацией понимается связывание диполей воды с ионными и полярными группами белка, такими как –СОО- , -NН3+, -СОNH2, -OH, -SH, в результате чего образуется гидратная оболочка белков (рис. 11). Благодаря этому каждая молекула белка покрывается несколькими молекулярными слоями воды, т.е. одна молекула белка отделена от другой слоем воды и находится в состоянии истинного раствора. Растворимость белковв воде возрастает при добавлении небольших количеств нейтральных солей (сульфат аммония, сульфат натрия, сульфат магния). Небольшие концентрации солей увеличивают степень диссоциации ионизированных групп, экранируют заряженные группы белка и тем самым уменьшают белок-белковое взаимодействие. Высокие концентрации нейтральных солей, напротив, осаждают белки из водных растворов, т.к. при больших концентрациях соли оттягивают на себя от молекул белка молекулы воды, т.е. лишают белок его гидратной оболочки. Так как степень диссоциации ионогенных групп белка определяет возможности гидратации белка, они хуже растворяются при рН равной его изоэлектрической точке (ИЭТ).
Факторами стабилизации белков в растворе являются наличие заряда поверхности белковой молекулы, броуновское движение молекул.
При добавлении в раствор белка органических растворителей вследствие уменьшения диэлектрической постоянной и уменьшения степени гидратации белков происходит их агрегация и выпадение в осадок.
Белковые растворы не являются типичными коллоидными растворами, т.к. белки диспергированы до единичных молекул и образуют гомогенный раствор. Сходство белковых и коллоидных растворов основано на том, что молекулы белков имеют размеры, приближающиеся к размеру мицелл коллоидного раствора. Растворы белков при определенных условиях могут терять текучесть и образовывать гели, возникающие в результате объединения молекул в виде сетки, внутреннее пространство которой заполнено растворителем. В виде гелей белки находятся в хрусталике глаза, гели образуются при сквашивании молока, при подготовке растений к зимнему периоду происходит переход части белков в гелеобразное состояние.
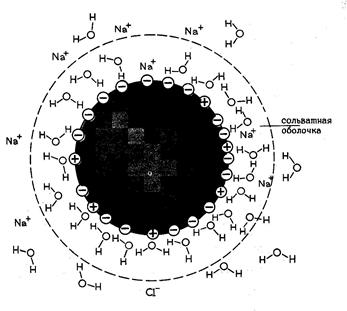
Рис.11. Образование гидратной (сольватной) оболочки белков
Благодаря гидрофильным и гидрофобным группировкам, белки могут влиять на растворимость других веществ, выступая в роли эмульгаторов. Например, как эмульсию можно рассматривать молоко, представляющее собой эмульгированные казеиногеном капельки жира в воде.
Одной из причин образования мочевых и желчных камней может быть недостаток муцинов - слизистых гликопротеинов, обволакивающих микрочастицы и способствующих тем самым выведению их из организма.
Ионизация белка и зависимость заряда от рН среды. Благодаря наличию в своем составе свободных амино- и карбоксильных групп белки являются полиэлектролитами (амфотерными электролитами). Белки в растворах находятся преимущественно в виде биполярных ионов (цвиттерионов, амфионов). При этом свободные карбоксильные группы белков оказываются диссоциированными (-СОО-), а свободные аминогруппы оказываются протонироваными (-NН3+). Таким образом, ионизация белков является следствием диссоциации свободных карбоксильных групп и протонирования свободных аминогрупп (рис.12).
В свою очередь степень ионизации (а значит и знак, и величина заряда) зависит от рН среды.
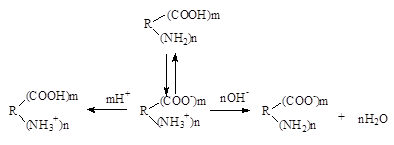
катион амфион анион
рН<7 рН>7
Рис.12. Схема ионизации белков
Значение рН, при котором число положительных зарядов равно числу отрицательных зарядов, называется изоэлектрической точкой данного белка. В растворах с рН ниже изоэлектрической точки белок приобретает положительный заряд, а выше ИЭТ отрицательный. В ИЭТ точке белки наиболее неустойчивы. Это может быть использовано для разделения белков. Белки с ИЭТ в области кислых значений рН характеризуются преобладанием кислых аминокислот (ГЛУ и АСП). ИЭТ белка выше 7 указывает на преобладание в составе белка основных аминокислот (АРГ, ЛИЗ, ГИС).
Способность белков к денатурации. Под денатурацией белка понимают нарушение нативной конформации белковой молекулы, приводящее к уменьшению или полной потере ее растворимости, изменению других физико-химических свойств, утрате специфической биологической активности. Денатурация не сопровождается разрывом пептидных связей и нарушением первичной структуры белка. Происходит расщепление дисульфидных мостиков, гидрофобных, ионных, водородных связей. В результате нарушается третичная структура и в значительной мере вторичная. Денатурацию белка вызывают как физические, так и химические факторы. К физическим денатурирующим факторам относятся: нагревание, ультрафиолетовый свет, высокое давление, механические воздействия, ультразвук. К химическим факторам денатурации относятся: тяжелые металлы, органические растворители, минеральные и органические кислоты, экстремальные значения рН, ионные детергенты.
Можно выделить следующие фазы денатурации: вначале при воздействии денатурирующего агента происходит ослабление внутренних связей, стабилизирующих белковую молекулу, плотность укладки полипептидных цепей уменьшается, внутрь молекулы белка могут проникать молекулы воды - это стадия рыхлого клубка, затем происходит полное развертывание полипептидной цепи белка - это стадия нити, в последующем полипептидная цепь укладывается в пространстве случайным образом, наступает стадия случайного клубка.
Денатурированный белок легче подвергается ферментативному гидролизу, поэтому термические способы обработки пищи способствуют лучшему усвоению пищевых белков. Во многих случаях денатурация является необратимым процессом (белки сваренного яйца). В некоторых случаях при медленном возвращении белка к оптимальным условиям (например, уменьшении концентрации мочевины) возможна его ренатурация, когда денатурирующий фактор действовал кратковременно и нанёс лёгкое разрушение молекуле. В последние годы установлено, что в организме есть белки, предотвращающие денатурацию. Шапероны - класс белков, защищающий в условиях клетки другие белки от денатурации. Они облегчают формирование пространственной конфигурации белков. К ним относятся белки теплового шока или белки стресса.
10. Растворы ВМС как лиофильные коллоидные растворы: особенности образования мицелл. Липосомы.
К лиофильным коллоидным растворам относятся растворы поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений (ВМС). Мицеллами лиофильных коллоидных растворов называются ассоциаты из молекул ПАВ и ВМС, возникающие самопроизвольно при концентрации, равной или большей критической концентрации мицеллообразования (ККМ), и образующие в растворе новую фазу. При концентрациях ПАВ < ККМ образуется монослой из молекул ПАВ, при концентрациях ПАВ ≈ ККМ начинают формироваться мицеллы из монослоев молекул ПАВ, с увеличением концентрации ПАВ строение мицелл усложняется, при более высоких концентрациях образуются бислойные структуры. Среди ПАВ, встречающихся в живом организме, к формированию бислоя в водных системах наиболее способны фосфо- и сфинголипиды, гидрофобный фрагмент которых состоит из двух углеводородных радикалов («двухвостые» молекулы). Липосомы представляют собой микрокапсулы диаметром 10-7 – 10-5 м, содержащие внутри воду, окруженную одним или несколькими бислоями из молекул фосфолипидов или сфинголипидов. По размерам и структуре они подобны клеткам живых тканей. Липосомы могут адсорбироваться на поверхности клеточной мембраны, при этом либо сливаться с клеточной мембраной, либо проникать внутрь клетки. Лиофильные системы термодинамически устойчивы, не имеют склонности к самопроизвольному разрушению и не требуют стабилизатора.
При образовании коллоидных частиц молекулы ПАВ ориентируются так, чтобы поверхность мицеллы по полярности была близка дисперсионной среде. В полярной дисперсионной среде (вода) поверхность мицеллы образована полярными группами, а ядро - гидрофобными фрагментами молекул ПАВ. В неполярной дисперсионной среде (масло) ядро мицеллы формируется из полярных групп, а ее поверхность - из гидрофобных фрагментов молекулы ПАВ.
При концентрациях ПАВ ниже ККМ на границе раздела между водным раствором и неполярной средой образуется монослой из молекул ПАВ. При концентрациях, превышающих ККМ, в растворе возникают сферические мицеллы. При дальнейшем увеличении концентрации сферические мицеллы превращаются в эллипсоидные, а затем - в цилиндрические, которые могут далее образовывать упорядоченные гексагональные структуры. Кроме объемных структур, при высоких концентрациях ПАВ образуются плоские - пластинчатые или дискообразные мицеллы, также способные далее объединяться в упорядоченные объемные структуры.
Среди ПАВ, содержащихся в живом организме, следует отметить фосфолипиды, склонные к образованию пластинчатых мицелл. При встряхивании или перемешивании таких коллоидных растворов возникают замкнутые бислойные микрокапсулы (полости), внутри которых содержится вода - липосомы. Поскольку липосомы близки по свойствам клеткам живых тканей, с их помощью удобно водить лекарственные средства в организм больного; этот метод получил название микрокапсулирования.
При дальнейшем увеличении концентрации ПАВ увеличение размера мицелл и их агрегирование приводит к образованию связнодисперсной системы - возникает сплошная гелеобразная структура из мицелл.
Таким образом, изменяя концентрацию или температуру, можно вызвать обратимые переходы в цепочке:
Истинный раствор ⇄ Коллоидный раствор ⇄ Гель
(молекулярный) (мицеллярный) (связнодисперсная система)
Образование мицелл в водных растворах ВМС подчиняется тем же закономерностям, что и в растворах ПАВ.
Дата добавления: 2015-05-26; просмотров: 7054;
