Устойчивость и разрушение растворов биополимеров. Высаливание и солюбилизация.
Высаливанием называется разрушение лиофильных коллоидных растворов в результате практически полной десольватации мицелл, сопровождающееся выделением ПАВ или ВМС в виде хлопьев. Высаливающее действие оказывают все ионы, независимо от знака их заряда, оно определяется их способностью к сольватации. Помимо электролитов высаливающее действие оказывают органические вещества, способные сильно связывать воду (этанол, ацетон).
Высаливающее действие на лиофильные коллоидные системы оказывают все ионы, независимо от их заряда. Оно определяется способностью ионов к сольватации, т.е. к связыванию растворителя. Чем больше способность ионов к сольватации, тем сильнее проявляется их высаливающее действие. По отношению к высаливанию белков в водных растворах ионы располагаются в следующие ряды:
Анионы: I- < Br- < NO3- < Cl- < CH3COO- < SO42- < C2O42-
Катионы: Cs+ < K+ < Na+ < Li+ < Ba2+ < Sr2+ < Ca2+ < Mg2+
У  силение высаливающего действия
силение высаливающего действия
Кроме электролитов, высаливающее действие на водные растворы белков оказывают органические вещества, склонные к сильной гидратации, например, этиловый спирт или ацетон.
Одним из важнейших свойств лиофильных коллоидных растворов является солюбилизация - самопроизвольный переход труднорастворимых низкомолекулярных соединений в водную фазу под действием коллоидных растворов ПАВ. Солюбилизация связана с проникновением молекул вещества в структуру мицелл. Этому способствует наличие в молекулярной структуре фрагментов, полярность которых близка к полярности ядра мицеллы. Внедрение посторонних молекул в мицеллу увеличивает ее размер, но не нарушает устойчивость дисперсной системы.
Солюбилизация является важнейшим фактором моющего действия ПАВ.
12. Особенности растворов ВМС: набухание и растворение. Зависимость величины набухания от различных факторов. Изоэлектрическая точка и методы ее определения.
Набухание – самопроизвольный процесс поглощения полимером растворителя, сопровождаемый увеличением объема и массы взятого образца ВМС.
Начальная стадия растворения ВМС заключается в диффузии молекул растворителя в объем полимера. Проникновение молекул растворителя в объем биополимера сопровождается увеличением его объема и массы, т.е. его набуханием.
Количественной мерой набухания является степень набухания а, которая может иметь объемное или массовое выражение:

где V0, V, m0, m - соответственно объемы и массы исходного и набухшего полимера.
Более точным является определение а по ее массовому выражению, так как в этом случае результаты измерений не зависят от явления контракции. Контракция заключается в том, что объем раствора (смеси) двух жидкостей оказывается меньше, чем сумма объемов взятых жидкостей.
В зависимости от структуры полимера и температуры набухание может быть ограниченным или неограниченным (рис. 13). При ограниченном набухании (1) а достигает предельного значения, после чего набухание не зависит от времени (желатин в холодной воде). Для неограниченного набухания характерна зависимость (2), проходящая через максимум, после чего падает до нуля в результате постепенного растворения полимера.
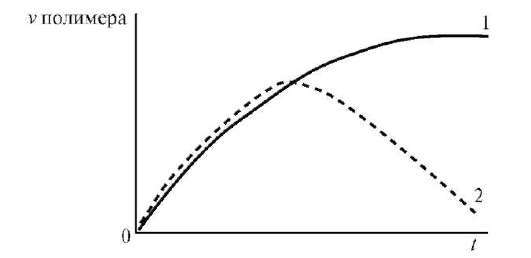
Рис. 13. Кривые ограниченного (1) и неограниченного (2) набухания
Ограниченность или неограниченность набухания определяются соотношением энергий связей в полимере с энергией сольватации и энтропийным фактором. В линейных и разветвленных полимерах молекулы связаны ван-дер-ваальсовыми силами, энергия этих связей невелика, поэтому энергия сольватации и энтропийный фактор уже при комнатной температуре превышают их. При таких условиях набухание идет неограниченно. Если между цепями полимера имеются химические связи, то для их разрыва недостаточно бывает энергии сольватации и энтропийного фактора. Набухание протекает ограниченно, и полимер превращается в студень.
В основе процесса набухания лежит сольватация макромолекулярных цепей. О сольватационном механизме набухания свидетельствуют выделение теплоты набухания и контракция (уменьшение общего объема системы). В то время как при набухании объем полимера всегда увеличивается, объем всей системы (полимер + растворитель) обычно уменьшается. Это особенно заметно при набухании полярных полимеров в полярных растворителях. Причиной контракции является упорядоченная ориентация молекул растворителя в сольватных слоях. Набухание, как и сольватация, специфично, так как полимер набухает в растворителе, соответствующем его природе. В процессе набухания происходит односторонняя диффузия молекул воды в полимер. Это объясняется тем, что крупные макромолекулы, связанные в надмолекулярные структуры, практически не могут переходить в растворитель, а мелкие и хорошо диффундирующие молекулы воды легко проникают в полимер, увеличивая его объем. При набухании отдельные молекулы надмолекулярных структур гидратируются, межмолекулярное взаимодействие значительно ослабевает, в результате чего становится возможной диффузия макромолекул в растворитель (рис. 14).

Рис. 14. Взаимодействие растворителя с полимером: 1 - межструктурное набухание; 2 - внутриструктурное набухание; 3 – растворение
Набухание является экзотермическим процессом, поэтому в соответствии с принципом Ле Шателье степень набухания увеличивается при увеличении давления и уменьшении температуры, однако скорость набухания при уменьшении температуры уменьшается, так как при более низких температурах диффузия протекает менее интенсивно.
Процесс набухания включает две стадии. На первой происходит выделение теплоты набухания наблюдается контракция системы, однако не достигает высоких значений. Вторая стадия почти не сопровождается контракцией и выделением теплоты, но характеризуется увеличением а и объема набухающего полимера.
При набухании полимеров их объем увеличивается в 10-15 раз, и возникает давление набухания, достигающее иногда сотен мегапаскалей. Силу давления при набухании крахмала и белков гороха раньше использовали для разъединения костей черепа при приготовлении анатомических препаратов. Давление набухания эквивалентно внешнему давлению, приложение которого могло бы остановить увеличение объема набухающего полимера.
Степень набухания полимера и его способность к растворению зависят от гибкости полимерных цепей. Так, волокна незрелого коллагена (в котором еще не установились поперечные ковалентные «сшивки») достаточно хорошо набухают и могут переходить в раствор, тогда как волокна зрелого коллагена нерастворимы. На интенсивность процесса набухания влияют также температура, давление, присутствие электролитов и величина pH.
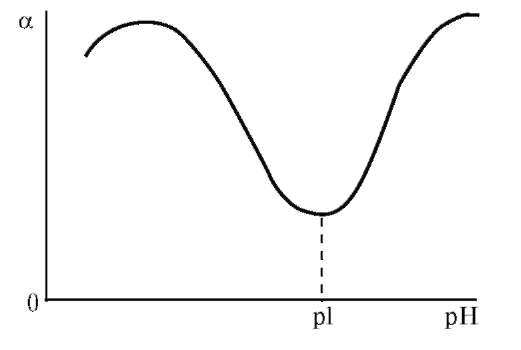
Рис. 15. График зависимости степени набухания белка от pH среды
Влияние pH среды на набухание особенно выражено для полиамфолитов. Зависимость степени набухания белка от pH среды выражается кривой с двумя максимумами и одним минимумом, положение которого соответствует изоэлектрической точке (рис. 15). Минимум набухания белков лежит в области их изоэлектрической точки рН = рI, а по обе стороны от этой точки располагаются максимумы набухания. В изоэлектрическом состоянии конформация белка наиболее плотная, поэтому степень его гидратации и, следовательно, степень набухания минимальны. В более кислой и более щелочной средах белок образует катионную или анионную формы, и его структура разрыхляется вследствие электростатического отталкивания одноименных зарядов.
С течением времени число связей между макромолекулами и внутри них возрастает, и степень набухания биополимера снижается. Постепенное старение живого организма сопровождается замедлением процессов обмена; вследствие утраты клетками мышц и кожи способности к набуханию образуются морщины. Примером влияния pH на набухание является отек кожи, вызываемый действием муравьиной кислоты, содержащейся в крапиве и выделениях муравьев.
Экспериментально установлено, что на набухание биополимеров анионы оказывают большее влияние, чем катионы. Анионы по степени влияния на набухание белков располагаются в лиотропный ряд (ряд Гоффмейстера):
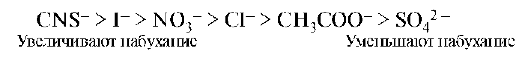
Белки относятся к полиамфолитам, т.е. к веществам, способным в зависимости от условий проявлять свойства, как оснований, так и кислот. Остатки ионогенных аминокислот (аспарагиновой и глутаминовой кислот, аргинина, лизина и гистидина) могут находиться как в протонированной, так и в депротонированной формах. Состояние, при котором суммарный заряд полиамфолита равен нулю, называется изоэлектрическим. Значение pH раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой (pI). В среде с большей кислотностью, чем в изоэлектрической точке (pH < pI), ионизация карбоксильных групп подавлена, вследствие чего белок находится в форме макрокатионов, положительный заряд которых обусловлен наличием -R-NH3+-групп. В среде с меньшей кислотностью, чем в изоэлектрической точке (pH > pI), карбоксильные группы депротонированы, вследствие чего белок находится в форме макроанионов, отрицательный заряд которых обусловлен наличием -R-СОО- -групп.
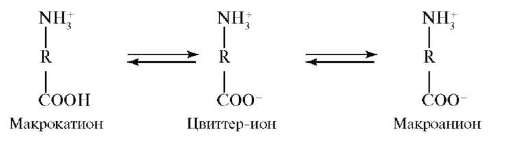
Возникновение электрического заряда в состоянии, отличающемся от изоэлектрического, обусловливает электрофоретическую подвижность белков. Направление движения макромолекул белков в электрическом поле (к катоду или аноду) зависит от значения pH. Белки, как и все амфолиты, имеют определенную величину изоэлектрической точки.
При pH < pI протонируются основные группы в боковых цепях; белок находится в форме макрокатиона и перемещается к катоду. При pH = pI белок находится в электронейтральной форме (макромолекула) и в электрическом поле не перемещается. При pH > pI белок перемещается к аноду, так как находится в форме макроаниона вследствие депротонирования кислотных групп в боковых цепях. Макроанионы различаются электрофоретической подвижностью, которая зависит от размера иона и его заряда. Изменяя pH поддерживающей среды, можно добиться значительного изменения подвижности макроаниона:
она будет тем больше, чем больше разница между pH и pI. Например, для белка с pI = 5 при pH= 9 степень депротонированности боковых ионогенных групп больше, чем при pH = 7. Больший заряд макроаниона при pH = 9 обусловливает его большую подвижность (рис. 16).
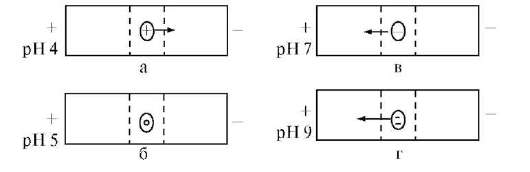
Рис. 16. Зависимость подвижности частиц белка (pI = 5) в электрическом поле от pH среды
Описанные закономерности используются в электрофоретическом методе анализа белков. С помощью электрофореза можно разделить на отдельные фракции сложные смеси белков. Некоторые заболевания сопровождаются изменением состава и соотношения белков, что отражается на электрофореграммах.
Дата добавления: 2015-05-26; просмотров: 7174;
