Аномальная вязкость растворов ВМС
Растворы ВМС только при очень больших разбавлениях (~0,01%) подчиняются законам Ньютона и Пуазейля. Характерной особенностью растворов ВМС является их высокая вязкость по сравнению с чистым растворителем даже при малых концентрациях.
Вязкостью (внутренним трением) называют свойство жидкостей оказывать сопротивление действию внешних сил, вызывающих их течение. Помимо этого растворы ВМС не являются ньютоновскими жидкостями, так как величина их вязкости (η) зависит от напряжения сдвига (р) - отношения тангенциально приложенной к образцу силы к единице поверхности (рис. 17).
Причины аномалии вязкости заключаются в наличии структурной вязкости у подобных систем. Структурная вязкость - это дополнительная вязкость, обусловленная добавочным сопротивлением течению со стороны внутренних надмолекулярных пространственных структур - сеток, нитей, крупных капель эмульсий. Вязкость таких систем не остается постоянной при увеличении напряжения сдвига, а резко падает, пока не достигает постоянной величины, но на более низком уровне вследствие разрушения структуры (рис. 18).
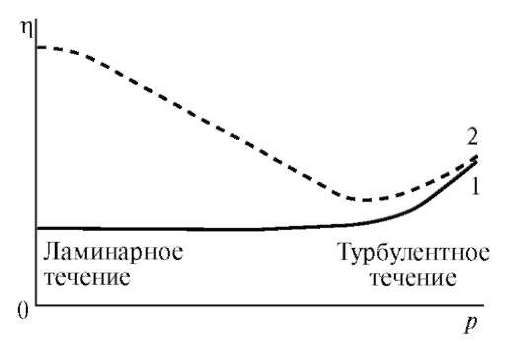
Рис. 17.Зависимость вязкости растворов низкомолекулярных веществ ньютоновских жидкостей (1) и растворов ВМС (2) от напряжения сдвига
Особенно сильно это свойство проявляется у полимеров с длинными линейными молекулами, например у каучука. Растворы полимеров с той же молекулярной массой, но со сферической формой молекул имеют меньшую вязкость. Отсюда следует, что вязкость растворов полимеров возрастает пропорционально асимметрии их молекул. При одинаковой химической структуре вязкость возрастает с увеличением молекулярной массы. Она зависит также от концентрации полимера и межмолекулярных сил взаимодействия.
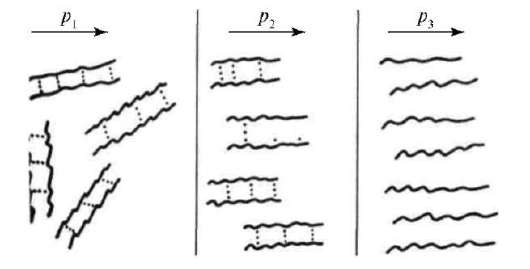
Рис. 18. Изменение структуры растворов ВМС при увеличении напряжения сдвига
Область постоянства вязкости аномально вязких жидкостей называют псевдопластической областью. Дальнейшее повышение напряжения сдвига вызывает увеличение коэффициента вязкости, что связано с турбулентностью.
Экспериментальные данные показывают, что коллоидные аномально вязкие системы могут течь и при очень малых давлениях и при этом вязкость остается постоянной, но очень высокой. Такое течение называют ползучестью.
Увеличение давления резко снижает вязкость ползучих систем, пока не наступает вторая область постоянства вязкости - псевдопластическая.
Аномалии вязкости вызываются рядом причин.
1. Структурообразование - процесс агрегации частиц коллоидных растворов, суспензий, растворов ВМС и образования пространственных легкоразрушимых структур.
2. Изменение ориентации в потоке частиц удлиненной формы и макромолекул при увеличении градиента скорости.
3. Деформация клубков макромолекул полимера или капель эмульсий в потоке.
С повышением температуры вязкость структурированных систем резко уменьшается за счет разрушения структуры. При понижении температуры доля структурной вязкости значительно увеличивается.
Для характеристики вязкости растворов пользуются величинами относительной и удельной вязкости. Относительную вязкость ηотн рассчитывают по уравнению:

где η - вязкость раствора; ηо - вязкость растворителя. Для расчета удельной вязкости используют соотношение:

Вязкость растворов ВМС увеличивается с возрастанием их средней молярной массы, поэтому вязкость растворов полимеров часто характеризуют приведенной вязкостью ηпр:
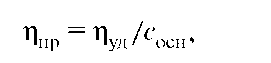
где Сосн - концентрация в основных молях:
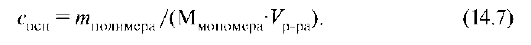
Приведенная вязкость увеличивается при увеличении концентрации (рис. 19).
Приведенную вязкость бесконечно разбавленного раствора называют характеристической вязкостью [η].
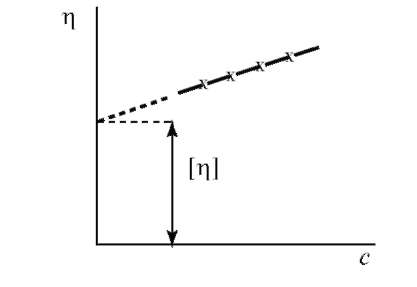
Рис. 19. График зависимости приведенной вязкости от концентрации
Растворы ВМС представляют собой истинные растворы, т.е. гомогенные, термодинамически устойчивые, не нуждающиеся в стабилизаторе, и образующиеся самопроизвольно системы. Однако растворы ВМС рассматривают в коллоидной химии, так как размеры их молекул приближаются, а в некоторых случаях даже превосходят размер коллоидных частиц. Кроме того, растворы ВМС в «плохих» растворителях содержат молекулы или агрегаты молекул с явно выраженной межфазной поверхностью. В концентрированных растворах ВМС обычно возникают достаточно большие ассоциаты молекул, которые можно рассматривать как вторую фазу. Наконец, растворы ВМС благодаря большим размерам их молекул обладают рядом свойств лиозолей: схожестью оптических свойств, малой скоростью диффузии, низким осмотическим давлением. Все это позволяет рассматривать многие проблемы одновременно и для коллоидных растворов, и для растворов ВМС.
В противоположность золям осмотическое давление растворов ВМС существенно и может быть измерено с достаточной точностью, что используется для определения их молекулярной массы.
С повышением концентрации ВМС их осмотическое давление перестает подчиняться закону Вант-Гоффа (π = cRT) и растет быстрее, причем экспериментально полученная кривая лежит выше теоретической прямой.
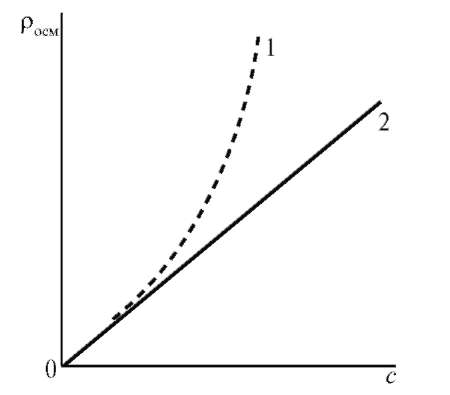
Рис. 20. Зависимость осмотического давления от концентрации раствора: 1 - раствор ВМС; 2 - раствор низкомолекулярного неэлектролита
Причиной отклонения от законов Вант-Гоффа является гибкость цепей ВМС, которые ведут себя, как несколько коротких молекул. Для расчета осмотического давления растворов ВМС предложено уравнение Галлера:

где c - концентрация раствора ВМС, г/л; М - молярная масса, г/моль; b - коээфициент, учитывающий гибкость и форму молекулы ВМС в растворе.
В сложных биологических системах суммарное осмотическое давление создается как низкомолекулярными электролитами и неэлектролитами, так и биополимерами. Составляющая суммарного осмотического давления, которая обусловлена наличием белков и других частиц коллоидного размера, называется онкотическим давлением. Доля онкотического давления относительно невелика: она составляет примерно 0,5% от суммарного осмотического давления (≈3,1кПа), однако отклонение этой величины от нормы приводит к серьезным нарушениям в функционировании организма.
Дата добавления: 2015-05-26; просмотров: 10841;
