Первый закон термодинамики и применение его к химическим процессам
Положение 1-го закона термодинамики записывается в виде равенства
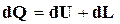 .
.
Для того чтобы применить это уравнение к химическим процессам, следует учесть, что протекание химических реакций связано с изменением состояния атомов и электронов в молекулах реагирующих веществ. При этом происходит изменение внутренней энергии, которое может проявиться в виде теплоты или работы.
При написании 1-го закона термодинамики применительно к химическим процессам следует учесть, что:
-в отличие от технической термодинамики все уравнения, как правило, записываются не для 1 кг, а для1 кмоль вещества;
-в величину работы входит не только работа расширения или сжатия газа, но и работа в результате действия электрических, световых и других сил, которые могут проявляться входе химической реакции. Работа в химической термодинамике обозначается буквой А.
При принятых замечаниях условия 1-го закона термодинамики, применительно к химическим реакциям, имеет вид
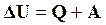 , (16.1)
, (16.1)
где ∆U – убыль внутренней энергии системы;
Q – теплота реакции;
А–работа реакции.
Таким образом, выделение теплоты в реакции и совершение работы осуществляется за счет изменения внутренней энергии системы. В химической термодинамике принято считать, что:
- уменьшение внутренней энергии положительно, а увеличение внутренней энергии отрицательно;
- теплота, выделившаяся в результате экзотермической реакции положительна, а поглощенная в результате эндотермической реакции, отрицательна.
Таким образом, в соответствии с принятым выше
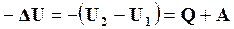 , или
, или 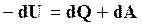 .
.
Работа реакции складывается из работы расширения или сжатия L, отнесенной к 1 моль, и работ электрических, магнитных, световых и других сил, обозначенных через Ах. Следовательно, работа реакции равна
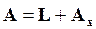 . (16.2)
. (16.2)
Так как
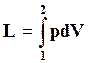 , то
, то 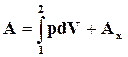 . (16.3)
. (16.3)
Изменение внутренней энергии может распределяться между теплотой и работой различно, и возможны крайние случаи, когда:
а)максимум внутренней энергии превращается в работу
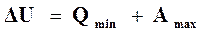 , (16.4)
, (16.4)
где 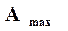 ─ максимальная работа реакции; при этом в реакции выделяется минимум теплоты, не превращенной в работу;
─ максимальная работа реакции; при этом в реакции выделяется минимум теплоты, не превращенной в работу;
б) в реакциях, кроме работы расширения и сжатия, другой работы не производится 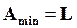 ; в этом случае имеем наибольшее количество теплоты и минимум работы
; в этом случае имеем наибольшее количество теплоты и минимум работы
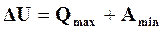 . (16.5)
. (16.5)
В первом случае реакция протекает в условиях полной обратимости, а во втором она не обратима.
16.2Теплоты реакций
Раздел химической термодинамики, занимающийся изучением теплот реакций, называется термохимией.
В химических процессах изменение состояния системы может характеризоваться не двумя, как в технической термодинамике, а тремя или более параметрами (например, давление, удельный объем, концентрация). При этом в процессе изменения состояния могут оставаться постоянными два параметра. Так как имические реакции рассматриваются идущими при постоянной температуре, то реакция, идущая при постоянном объеме, называется изохорно-изотермической (V, T)= const, а реакция, идущая при постоянном давлении, называется изобарно-изотермической (р, Т)=const.
Для реакций между твердыми и жидкими телами или для газовых реакций, идущих в постоянном объеме, dV=0,
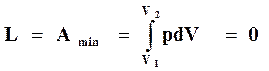 ,
,
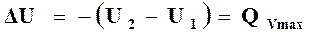 , (16.6)
, (16.6)
где 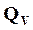 – теплота изохорно-изотермической реакции, соответствующая изменению внутренней энергии.
– теплота изохорно-изотермической реакции, соответствующая изменению внутренней энергии.
Для химической реакции, протекающей при постоянном давлении, 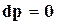 ,
,
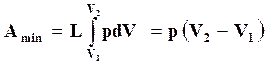 ,
, 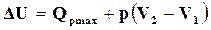 , (16.7)
, (16.7)
где 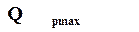 – теплота реакции при постоянном давлении.
– теплота реакции при постоянном давлении.
Теплота химической реакции при 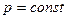 и отсутствии всех видов работы, кроме работы расширения, сжатия, называется тепловым эффектом реакции,как это принято в физической химии.
и отсутствии всех видов работы, кроме работы расширения, сжатия, называется тепловым эффектом реакции,как это принято в физической химии.
Тепловой эффект реакции при 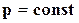
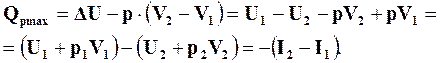 (16.8)
(16.8)
где 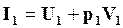 и
и 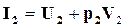 – начальная и конечная энтальпии системы.
– начальная и конечная энтальпии системы.
В зависимости от вида реакции ( 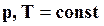 или
или 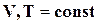 ) получаются различные теплоты реакций.
) получаются различные теплоты реакций.
Связь между ними может быть получена исходя из соотношений (16.7) и (16.8). Подставив значение 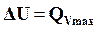 в формулу (16.8) имеем
в формулу (16.8) имеем
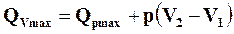 . (16.9)
. (16.9)
Если в реакции участвуют газообразные вещества, то из уравнения состояния идеального газа
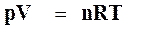 ,
,
где n ─ число молей газа в объеме V; R ─ универсальная газовая постоянная, равная R = 8,3143 кДж/(моль∙град); для изобарно-изотермической реакции ( 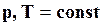 )
)
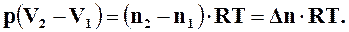 (16.10)
(16.10)
Подставляя выражение (16.10) и (16.9), получим
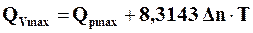 . (16.11)
. (16.11)
Таким образом, связь между теплотами реакций (рТ) = const или (VТ) = const зависит как от температуры, при которой идет реакция, так и от изменения в ней числа молей, газообразных реагентов.
При ∆n>0, например, в реакции* (* обозначения в вышеприведенных примерах означают: (Т) – твердое, (Ж) – жидкое и (Г) – газообразное состояния).
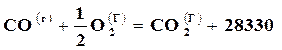 кДж /моль, то
кДж /моль, то 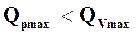 .
.
В этом случае система совершает работу расширения.
Если ∆n<0, примером такой реакции может служить реакция
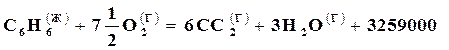 кДж / моль,
кДж / моль,
то 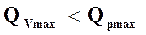 .
.
При этом система воспринимает работу, совершаемую внешней средой (работу сжатия).
Если число молей в реакции остается постоянным ∆n=0, например в реакции
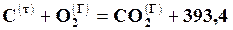 кДж/моль, то
кДж/моль, то 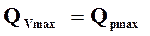 .
.
При составлении термохимических уравнений важно знать, в каком состоянии находятся реагирующие вещества, так как величина теплоты реакции зависит от их агрегатного состояния. Обычно в термохимических уравнениях, если это специально не оговорено, фигурируют теплоты реакций при постоянном давлении, 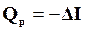 .
.
При вычислении величины изменения энтальпии не имеет значения, какое состояние берется за начало отсчета. В термохимии принято за стандартное состояние – состояние элементов при Т = 298 Ки р = 1,0133 бар. Для элементов в стандартном состоянии величина 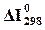 равна нулю. (Нижний индекс в этой величине указывает на стандартную абсолютную температуру, верхний – на стандартное давление). Теплота образования вещества из элементов, определенная при стандартных условиях, называется стандартной теплотой образования и обозначается
равна нулю. (Нижний индекс в этой величине указывает на стандартную абсолютную температуру, верхний – на стандартное давление). Теплота образования вещества из элементов, определенная при стандартных условиях, называется стандартной теплотой образования и обозначается 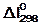 .
.
Большинство соединений образуется из элементов с выделением теплоты и соответственно табличные величины стандартных теплот образования отрицательны и лишь для немногих эндотермических соединений, например NОх( 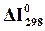 ), – положительны. Стандартная теплота сгорания представляет собой изменение энтальпии при реакции данного вещества с элементарным кислородом, причем исходные вещества и продукты реакций должны быть взяты при стандартных условиях. Стандартная теплота какой-либо реакции может быть определена с помощью ряда таких реакций образования и сгорания, которые бы в сумме составили изучаемую реакцию. Стандартные эффекты реакций представляют собой изменение энтальпии реагентов в результате химической реакции до продуктов реакции в стандартных условиях. Обычно теплоты образования известны для неорганических соединений, а теплоты сгорания для органических. При расчете двигателей внутреннего сгорания и воздушно-реактивных двигателей используют теплоту сгорания топлива.
), – положительны. Стандартная теплота сгорания представляет собой изменение энтальпии при реакции данного вещества с элементарным кислородом, причем исходные вещества и продукты реакций должны быть взяты при стандартных условиях. Стандартная теплота какой-либо реакции может быть определена с помощью ряда таких реакций образования и сгорания, которые бы в сумме составили изучаемую реакцию. Стандартные эффекты реакций представляют собой изменение энтальпии реагентов в результате химической реакции до продуктов реакции в стандартных условиях. Обычно теплоты образования известны для неорганических соединений, а теплоты сгорания для органических. При расчете двигателей внутреннего сгорания и воздушно-реактивных двигателей используют теплоту сгорания топлива.
Теплотой сгорания топлива называют количество теплоты, выделенной при полном сгорании 1 кг или 1 м3 топлива. Теплоту сгорания топлива определяется опытным путем в бомбе при постоянном объеме – НuV или в калориметре при постоянном давлении Нup
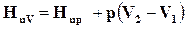 .
.
Разница между 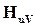 и
и 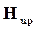 не превышает 0,5– 1,5%, поэтому принимают
не превышает 0,5– 1,5%, поэтому принимают
 .
.
Дата добавления: 2015-04-05; просмотров: 4108;
