Химический потенциал
При рассмотрении термодинамических процессов количество вещества в системе считалось неизменным. В химических реакциях, когда из одних веществ образуются другие, изменяются и массы отдельных компонентов. При переменном составе системы любое из свойств системы может быть представлено как функция количества вещества m и любых из двух переменных p, V, T, U, S, F и т. п.
Так, например, дифференцируя уравнение 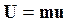 ,
,
(где u– внутренняя энергия количественной единицы вещества), получим
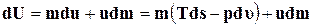 .
.
Так как
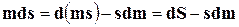 ,
, 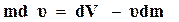 , то
, то
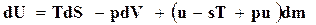 . (16.49)
. (16.49)
Величина 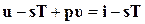 называется химическим потенциалом и обозначается через μ.
называется химическим потенциалом и обозначается через μ.
Таким образом, уравнение (16.49) можно записать в следующем виде:
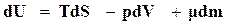 ( 16.50)
( 16.50)
и по аналогии
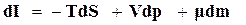 , (16.51)
, (16.51)
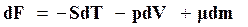 , (16.52)
, (16.52)
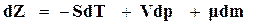 . (16.53)
. (16.53)
Взяв соответствующие производные по уравнениям (16.50) – (16.53), получим
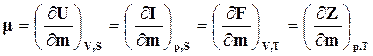 . (16.54)
. (16.54)
Следовательно, химический потенциал есть частная производная одной из термодинамических функций по массе при постоянных значениях соответствующих независимых переменных. Если термодинамические процессы идут при 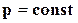 и
и 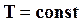 , то из уравнения (16.53) следует
, то из уравнения (16.53) следует
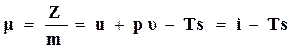 . (16.55)
. (16.55)
Так как все рассмотренные термодинамические функции U, I, S, F, Z и т. п. имеют размерность энергии, то согласно формуле (16.54) химический потенциал характеризует изменение энергии при изменении массы данного вещества на единицу.
Химический потенциал был впервые введен Гиббсом и отнесен им к единице массы. Он играет большую роль в термодинамике фазовых превращений и химической термодинамике, так как в этих разделах рассматриваются процессы, идущие с перераспределением массы системы.
Дата добавления: 2015-04-05; просмотров: 569;
