Сопряженное присоединение к аф-непределъным карбонильным соединениям. Аннелирование по Робинсону и присоединение по Михаэлю с независимой вариацией аддендов
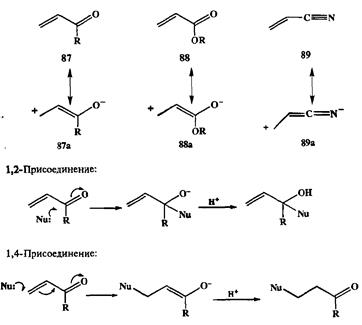 Схема 2.29
Схема 2.29
|
Рассмотренные выше реакции карбонильных соединений при всей широте их применения и синтетической значимости достигаемых с их помощью превращений далеко не исчерпывают тот огромный синтетический потенциал, который заложен в химии карбонильной группы. Качественно новые возможности появляются в системах, где карбонильная группа находится в сопряжении с двойной связью углерод—углерод. В таких структурах, типичными представителями которых являются соединения типа 87—89, я-электроны кратных связей образуют единую сопряженную систему, в пределах которой легко передаются эффекты поляризации связей. В силу этого подобные соединения в реакциях с нуклеофилами могут вести себя либо как уже знакомые нам карбонильные электрофилы, либо проявлять свойства электрофилов иного типа, в которых электрофильный центр локализован на р-углеродном атоме, как это отражено в канонических формулах 87а—89а.В результате подобные непредельные соединения, такие, как, например, <х,|3-непредельные кетоны или эфиры, могут подвергаться атаке нуклеофилом и по карбонильному атому углерода, и по р-углеродному атому (схема 2.29).
Первое из этих направлений нам уже хорошо известно и в случае показанной на схеме реакции с енонами его результатом является образование ал-лиловых спиртов — чрезвычайно полезных синтетических полупродуктов. Однако еще более интересные синтетические возможности открывает второй путь, 1,4-присоединение нуклеофилов, известное какреакция Михаэля [13]. В классическом варианте этой реакции в качестве таких нуклеофилов используют стабилизированные карбанионы, производные соединений типа малоново-го эфира или нитрометана, которые генерируют под действием слабых оснований непосредственно в реакционной среде в присутствии акцепторов Михаэля, например, метилвинилкетона (90), как это показано на следующих примерах:
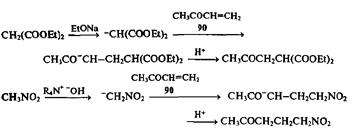
Реакция Михаэля представляет собой очень эффективный способ удлинения углеродной цепи электрофила на три (и более) атома углерода. Читатель, конечно, обратил внимание на то, что типичные акцепторы Михаэля, как, например, (90), — это продукты конденсации карбонильных соединений, которые могут быть получены по схеме альдольной конденсации (см. 73, схема 2.26), реакции Виттига (см. 82, схема 2.28), реакции Перкина или Манниха (см. ниже). Подчеркнем также, что типичными нуклеофильными компонентами реакции Михаэля служат ионные еноляты, производные карбонильных соединений. Таким образом, условия, требуемые для получения акцепторов Михаэля, очень схожи или даже идентичны условиям проведения самой реакции Михаэля. Эти обстоятельства создавали предпосылки для того, чтобы «состыковать» обе реакции — получение акцептора Михаэля и присоединение к нему нуклеофильного реагента — в связанную последовательность превращений, проводимых в одной колбе без выделения промежуточно образующихся продуктов. Более того, можно было ожидать, что функционально замещенные карбонильные соединения, типичные аддукты, получающиеся в результате реакции Михаэля, в тех же условиях могут быть далее вовлечены в такие типичные для них превращения, как, например, внутримолекулярная альдольная конденсация. Первым примером подобного согласованного проведения последовательности реакций карбонильных соединений явилосьаннелирование по Робинсону [14а,B], стандартный путь создания шестичленного цикла, — метод, широко применяемый в полном синтезе множества природных соединений. Типичный пример такой последовательности приведен на схеме 2.30.
Ключевая стадия показанной цепочки превращений — присоединение енолята 91 по двойной связи енона 90 [14с] (реакция Михаэля). Первичным продуктом этой реакции является тоже енолят-анион 92, способный к обратимой изомеризации в енолят 93. Нуклеофильный центр последнего пространственно сближен с имеющимся в молекуле электрофильным центром, карбонильной группой циклогексанового кольца, благодаря чему в условиях реакции достаточно легко протекает внутримолекулярная альдольная конденсация, сопровождающаяся дегидратацией, и в результате образуется би-циклический ендион 94. Показанный дикегон является одним из важнейших промежуточных полупродуктов в синтезе полициклических терпеноидов и стероидов, поскольку он содержит имеющуюся во многих из этих соединений систему А/В циклов, ангулярную метальную группу, кетонную группу в цикле В и еноновый фрагмент в цикле А, что обусловливает возможность реализации последующих синтетических трансформаций самых различных типов.
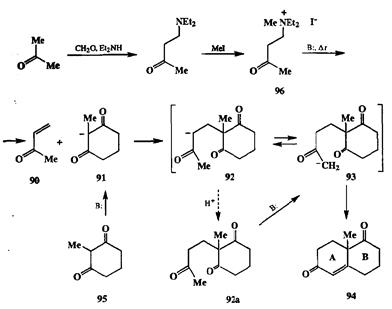 Схема 2.30
Схема 2.30
|
Препаративные достоинства аннелирования по Робинсону очевидны. Последовательность стадий 90 + 91 -» 94 проводится в одну операцию. Более того, генерирование енолята из кетона 95 и акцептора Михаэля 90 из 96 также могут проводиться в одном реакционном сосуде. Последнее особенно важно из-за малой устойчивости метилвинилкетона (90) к длительному хранению. Генерация 90 in situ осуществляется посредством обработки четвертичной аммониевой соли 96 сильным основанием [14а]. Таким образом, если смесь реагентов 95 и 96 нагревать в присутствии сильного основания (амид натрия), то запускается показанная на схеме 2.30 последовательность превращений, даю-шая в конце концов бициклический дикетон 94. К сказанному можно добавить, что синтетический эквивалент енона 90, аммонийная соль 96, может быть в свою очередь легко получена из тривиальных соединений (ацетона, формальдегида и диэтиламина) по реакции Манниха [14d]) — реакции, в об щем-то очень близкой вышеописанным карбонильным конденсациям, с последующим N-алкилированием получаемого продукта метилиодидом.
Читатель мог заметить, что показанное на схеме 2.30 превращение моноциклического дикетона 95 в бициклический продукт 94 (циклогексаноанне-лирование) по сути дела представляет собой последовательность двух тривиальных реакций, а именно: присоединения по Михаэлю и альдольной конденсации. Почему же, в таком случае, этому синтетическому протоколу присвоено название «аннелирование по Робинсону»? Конечно, и альдольная конденсация, и реакция Михаэля были открыты задолго до исследований Робинсона. Однако безусловной заслугой последнего было осознание стратегических преимуществ синтетических решений, основанных на исчерпывающем использовании потенциала функций, имеющихся в исходных веществах. По сути дела Робинсоном была предложена новая стратегия построения шестичленного фрагмента с помощью тандемной последовательности простых и надежных реакций. Смысл этой стратегии по существу очень прост. Он заключается в том, что карбанионный интермедиат 92, образующийся на первой стадии реакции Михаэля, не перехватывается протоном из среды (как это обычно происходит в классической методике проведения реакции Михаэля) с образованием ковалентного продукта 92а, а используется на следующей стадии в качестве генерированного in situ нуклеофила, реагирующего (через стадию эквилибрирования с енолятом 93) с карбонильным электрофнлом по схеме внутримолекулярной альдольной конденсации (очевидно, что необходимым условием такого хода реакции является отсутствие в среде активных доноров протона). Это принципиальное преимущество можно в общем виде уяснить, если сравнить показанные на рис. 2.5 схемати ческие энергетические профили двух вариантов последовательностей для преврашения 95 в 94: (а) по схеме классической реакции Михаэля через ковалентный аддукт 92а и (B) по методу Робинсона через интермедиаты 92 и 93.
К настоящему времени разработано множество вариантов проведения тан-демных последовательностей превращений, аналогичных показанной на схеме 230, для самых разнообразных типов акцепторов Михаэля и а,р-непредельные карбонильных производных, и аннелирование по Робинсону считается сейчас одним из наиболее общих и надежных способов построения циклогексеноно-вого фрагмента почти в любом структурном контексте [14Ь,е]).
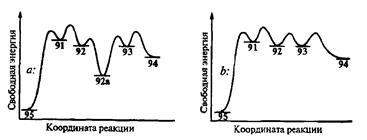 Рис 2.5
Схематические энергетические профили для двух вариантов образования 94 взаимодействием 95 и 90: классический, с раздельным выполнением стадий (а) и с выполнением обеих стадий в связной последовательности в одном реакционном сосуде (по Робинсону) (/>)
а — исходный дикетш 95 образует енолят 91, реакция которого с электрофилом 90 дает промежуточный карбанион 92. Последний присоединяет протон из среды и превращается в ко-валентное соединение 92а. Для выполнения следующей стадии необходимо снова затратить определенную энергию для генерации енолята 93, который и превращается далее в продукт 94.
B — исключается ненужный «спуск с горы» (92 -> 92а) и повторный подъем в гору (92а -» 93), а промежуточный енохят 92 непосредственно используется (через эквилибрирование с 93) на завершающей стадии.
Рис 2.5
Схематические энергетические профили для двух вариантов образования 94 взаимодействием 95 и 90: классический, с раздельным выполнением стадий (а) и с выполнением обеих стадий в связной последовательности в одном реакционном сосуде (по Робинсону) (/>)
а — исходный дикетш 95 образует енолят 91, реакция которого с электрофилом 90 дает промежуточный карбанион 92. Последний присоединяет протон из среды и превращается в ко-валентное соединение 92а. Для выполнения следующей стадии необходимо снова затратить определенную энергию для генерации енолята 93, который и превращается далее в продукт 94.
B — исключается ненужный «спуск с горы» (92 -> 92а) и повторный подъем в гору (92а -» 93), а промежуточный енохят 92 непосредственно используется (через эквилибрирование с 93) на завершающей стадии.
|
В рассмотренной связанной последовательности первая стадия является межмолекулярной реакцией акцептора Михаэля 90 с карбанионом, генерированном из кетона 91, а вторая — внутримолекулярной реакцией полученного енолятного интермедиата с электрофилом, карбонильной группой того же кетона 91. Уместно задаться вопросом, возможна ли реализация подобной же схемы раздельного присоединения к акцептору Михаэля для тех случаев, когда нуклеофил и электрофил не принадлежат одной и той же молекуле или, иными словами, когда обе стадии присоединения являются межмолекулярными? Ответ на этот вопрос нетрудно дать, если на основе приведенного выше рассмотрения аннелирования по Робинсону попытаться сформулировать в общем виде те условия, которые необходимы и достаточны для обеспечения такого хода реакции. Очевидно, что для этого, во-первых, необходимо проводить стадию присоединения нуклеофила по кратной связи акцептора Михаэля в отсутствие активных электрофилов (например, протона), способных немедленно «гасить» образующийся при этом карбанионный интермедиат. Это, в частности, означает, что реакцию надо проводить в апротонной среде. Во-вторых, необходимо также, чтобы этот интермедиат являлся стабильным, способным существовать в растворе как кинетически независимая частица вплоть до момента, когда в реакционную смесь будет прибавлен внешний электрофил. Естественно, требуется также ввести к минимуму возможность реакции образующегося нуклеофильного интермедиата с исходным электрофильным субстратом. Все эти условия могут быть соблюдены путем выбора соответствующих реагентов и условий проведения реакции, и во всех таких случаях реакция Михаэля может быть проведена как последовательность кинетически независимых стадий присоединения нуклеофила (Nu) и электрофила (Е) по связи С=С исходного субстрата или, иными словами, реализована в виде двух последовательных межмолекулярных реакций.
Сказанное выше является по сути дела всего лишь логическим следствием классической схемы описания процесса нуклеофильного присоединения по кратным связям как двустадийной реакции. Примечательно, однако, что на основе подобного анализа удалось разработать новую и очень продуктивную методологию, применимую для решения широкого круга синтетических задач. Одним из первых примеров успешного использования последовательности независимых стадии присоединения Nu и Е по двойной связи акцептора Михаэля был описанный Сторком [ 15а] синтез аддукта 97 (схема 2.31) — полупродуктав полном синтезе полициклического алкалоида ликоподина.
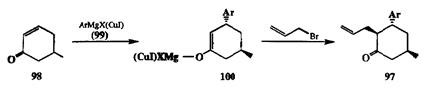 Схема 2.31
Схема 2.31
|
Как показано на этой схеме, на первой стадии енон 98 реагирует с арил-магнийкупратным реагентом 99, давая продукт присоединения карбаниона Аг~, енолят 100.Последний при последующей обработке электрофилом, ал-лилбромвдом, превращается в конечный продукт 97. Суммарным итог показанного превращения — «сборка» целевой молекулы из трех предшественников с образованием двух новых связей С-С. Здесь также уместно подчеркнуть, что на примере этого синтеза бьшо показано принципиально важное значение применения купратных реагентов в качестве нуклеофилов на первой стадии реакции, присоединении по Михаэлю. Во-первых, реагенты этого типа (например, 99) обеспечивают практически полную селективность атаки по р-углеродноу атому сопряженной системы, что, как правило, трудно достижимо для реагентов типа литий- или магнийорганических соединений. Во-вторых, получающиеся в результате этой стадии купратные еноляты (например, 100)из-за своей пониженной основности и нуклео-фильности, являются существенно более стабильными интермедиатами по сравнению с соответствующими литий- или магнийпроизводными и менее склонны, чем последние, к участию в побочных реакциях. Благодаря этим особенностям именно купратные реагенты чаще всего используются в качестве нуклеофилов в реакциях типа присоединения по Михаэлю [ 15b-d].
К настоящему времени описаны многие десятки синтезов соединений различных типов, выполненных по обшей схеме трехкомпонентного сочетания, представленной выше для синтеза 97, с использованием самых разнообразных акцепторов Михаэля, нуклеофилов (как правило, купратного типа) и электро-филов. Благодаря показанной возможности почти неограниченных вариаций в природе всех участвующих компонент [15е], тандемная последовательность раздельных стадий — присоединения нуклеофила по Михаэлю/алкилирова-ние енолята — стала одним из самых эффективных стратегических приемов в современном органическом синтезе (подробнее об этом см. разд. 3.2.7).
Дата добавления: 2015-04-05; просмотров: 1833;
