Ретросинтетический анализ ациклических целевых структур. Общие рекомендации.
Выше мы рассмотрели лишь некоторые наиболее типичные и часто употребляемые методы сборки связей С-С и С=С. Эта выборка, несмотря на ее Неизбежную ограниченность, дает возможность сформулировать ряд общих рекомендаций по рациональной разборке ациклических целевых молекул при их ретросинтетическом анализе. Эти рекомендации перечислены ниже.
1. Простая связь С—С в отсутствие близко расположенных функциональных групп.
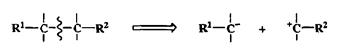 Схема 2.34
Схема 2.34
|
При этом эквивалентами карбанионов могут служить купратные комплексы литий- или магнийорганических реагентов, а эквивалентами карбокатионов — производные типа алкилгалогенидов, алкилсульфонатов или алкилацетатов (схема 2.34).
2. Простая связь С—С, один из атомов которой несет кислородный заместитель.
 Схема 2.35
Схема 2.35
|
Разборка, показанная на схеме 2.35, представляет собой ничто иное, как ретрореакцию Гриньяра. Очевидными эквивалентами показанных на схеме электрофилов и нуклеофилов являются соответственно карбонильные производные разных типов и магний- или литийорганические соединения.
3. Простая связь С-Св аллильном положении.
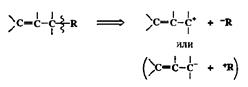 Схема 2.36
Схема 2.36
|
Такая разборка допускает широчайшие возможности для выбора реагентов, соответствующих показанным на схеме комбинациям электрофил + нуклеофил. Поэтому неудивительно, что при ретросинтетическом анализе соединений, содержащих кратные связи углерод—углерод, в первую очередь обычно рассматриваются варианты, типа представленных на схеме 2.36.
4. Простая связь С-С в системе, содержащей два кислородных заместителя в положении 1,3.
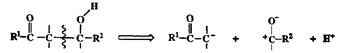 Схема 2.37
Схема 2.37
|
Легко видеть, что на этой схеме представлено расщепление, соответствующее ретроальдольной конденсации, позволяющее непосредственно выйти к структурам требуемых реагентов, эквивалентов нуклеофила (енолят-иона) и электрофила (карбонильного производного) (схема 2.37).
5. Двойная связь С=С в оцр-непредельных карбонильных соединениях.
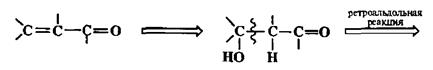 Схема 2.38
Схема 2.38
|
Показанная на схеме 2.38 ретросинтетическая гидратация двойной связи приводит нас к уже рассмотренному выше случаю. Альтернативное расщепление может быть проведено по схеме ретрореакции Виттига (см. ниже).
6. Двойная связь С=С почти в любом структурном контексте.
Расщепление по схеме ретрореакции Виттига (1) предполагает разрыв по атомам углерода, связанным двойной связью. В силу доступности исходных веществ и возможности осуществления эффективного стереоконтроля реакция Виттига справедливо рассматривается как наиболее универсальный путь построения алкенового фрагмента.
На схеме 2.39 показаны еще две возможности ретросинтетического анализа алкенов, основанные на хорошо известных схемах превращений ацетиленовых производных. В первой из них (2) расщепление проводится по обоимвинильным связям, что соответствует ретрокарбометаллированию. Этот подход особенно ценен для тех случаев, когда необходимо обеспечить полную стереоселективность образования трехзамешенной двойной связи. Путь (3), пожалуй, можно считать самым простым и препаративно удобным, но он применим лишь для синтеза 1,2-дизамещенных алкенов. Здесь первой стадией ретросинтетического анализа служит дегидрирование, что автоматически сводит задачу построения рассматриваемого алкенового фрагмента к задаче синтеза соответствующего дизамещенного ацетилена с помощью хорошо известных реакций ацетиленидов металлов с электрофилами.
7. Простая связь С-С в системе, содержащей два кислородных заместителя в положении 1,5.
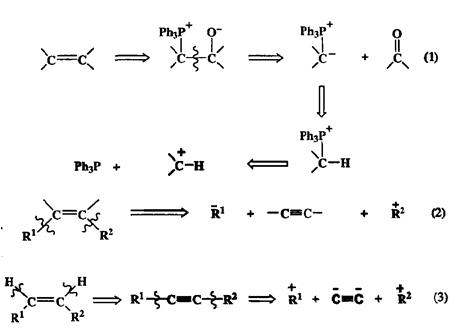 Схема 2.39
Схема 2.39
|
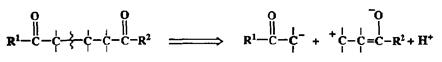 Схема 2.40
Схема 2.40
|
Разборка, показанная на схеме 2.40, соответствует ретрореакции Михаэля, приводящая к двум ионам, синтетические эквиваленты которых довольно очевидны. Это карбонильное соединение как предшественник енолят-иона (нуклеофила) и а,р-непредельное карбонильное соединение (акцептор Михаэля), выступающий в роли электрофила.
Конечно, вышеприведенным далеко не исчерпываются возможности ре-тросинтетического анализа рассматриваемых структурных типов. Это лишь те наиболее очевидные ходы, которые стоит рассматривать в первую очередь в поисках наиболее практичных путей синтеза. При оценке этих и других возможных альтернатив необходим учет множества факторов, таких, как относительная стабильность ионов (и/или их эквивалентов), на которые разбирается молекула при том или ином варианте анализа, общность и эффективность соответствующих синтетических методов, доступность требуемых предшественников, возможности осложнения хода рассматриваемой реакции из-за наличия других функциональных групп и т.п.
Дата добавления: 2015-04-05; просмотров: 1567;
