Классификация функциональных групп и их взаимопревращений
Можно использовать самые различные подходы для классификации функциональных групп и путей их взаимопревращений. Для наших целей наиболее подходящим кажется подход, основанный на рассмотрении состоянии окисления атомов, входящих в состав функциональных групп [19Ь]. Этот принцип и будет использован ниже, причем в первую очередь, естественно, нас будет интересовать состояние окисления атомов углерода в той или иной функциональной группе.
Как известно, окислением называют реакции, связанные с потерей атомом (или молекулой) электронов. Достаточно легко установить происходящие при этом изменения в состоянии окисления реагирующих партнеров для чисто ионных реакций. Однако для превращений ковалентных органических соединений понятия «окисление» или «восстановление» далеко не всегда кажутся столь же очевидными. Действительно, если речь идет об окислении первичного спирта в карбоновую кислоту (или обратном процессе), об окислении алкенов в эпоксиды или их превращении в алканы, то ясно, что это все — типичные окислительно-восстановительные реакции. Но уже классификация в тех же терминах таких реакций присоединения по двойной связи, как гидратация или бромирование, и обратных им реакций элиминирования не кажется столь же определенной. Тем не менее и по отношению к подобного рода реакциям можно уверенно использовать понятия окисления и восстановления, если опираться на определенные формальные критерии и принять за начало отсчета степень окисления углерода в алканах (уровень окисления 0).
Рассмотрим связь С-Н в алканах. Углерод более электроотрицательный элемент, чем водород. Вследствие этого электронная пара этой связи смещена к атому углрода, что в утрированной форме может быть представлено ионной формулой 122(схема 2.45). Нетрудно видеть, что при таком рассмотрении атом углерода в составе фрагмента С-Н аппроксимируется кар-банионом, которому таким образом и приписывается уровень окисления 0. К ионной системе такого типа уже однозначно применимы традиционные представления об окислительно-восстановительных реакциях. Так, окисление 122с переносом одного электрона приводит к радикалу 123,в го время как окисление с потерей двух электронов дает карбокатион 124.При такой трактовке переход от алканов к спиртам и далее к альдегидам и карбоновым кислотам может четко классифицироваться как процесс окисления с потерей двух, четырех или шести электронов и образованием функциональных производных уровней окисления I, 2 и 3 соответственно. Аналогичным образом можно интерпретировать переход от алканов к алкенам и алкинам (см. схему 2.45).
Такое рассмотрение создает вполне логичную основу для классификации функционально замещенных соединений как производных алканов, для чего требуется чисто формально рассмотреть изменение уровня окисления атомовуглерода последних, которое требуется для формирования той или иной функциональной группы или групп (см. схему 2.46).
 Схема 2.45
Схема 2.45
|
Еще более важным является то обстоятельство, что подобная классификация позволяет четко разделить все трансформации функциональных групп на два главных типа, а именно: изогипсические реакции, т. е. реакции, в результате которых не происходит изменений в уровнях окисления углеродных атомов, затрагивамых в этих превращениях, и неизогипсические реакции, результатом которых может быть окисление (повышение уровня окисления) или восстановление (понижение уровня окисления).
Оценку изменения уровня окисления органического соединения в ходе того или иного превращения проще всего сделать, если проследить за изменением уровня окисления соответствующего реагента. Так, например, образование спиртов в результате гвдратации алкенов, равно как и обратная реакция дегидратации безусловно относятся к категории изогипсических превращений, поскольку в них участвует вода, не играющая здесь роли окислителя или восстановителя. Напротив, любые варианты гидроксилиро-вания алкенов, ведущие к образованию 1,2-гликолей, описываются как формальное присоединение пероксида водорода, несомненного окислителя, и потому должны быть отнесены к разряду неизогипсических, окислительных реакций. Также неизогипсическими являются такие реакции, как присоединение водорода (восстановитель!) или брома (окислитель!) по двойным или тройным связям и соответствующие им обратные реакции (де-гвдриривание и дегалогенирование).
Следуя той же логике рассуждений, мы приходим к вывода, что образование литийорганичсских соединений или реактивов Гриньяра при действии металлов (восстановителей) на алкилгалогениды есть неизогипсическая восстановительная реакция, при которой субстраты с уровнем окисления 1 восстанавливаются до соединений уровня окисления 0, отвечающего алканам. Таким образом, получается, что металлоорганические соединения оказываются уникальными функциональными производными, имеющими нулевой уровень окисления. Этот довольно парадоксальный вывод подтверждается тем, что гидролиз этих соединений, т. е. заведомо изогипсическая реакция, приводит именно к углеводородам:
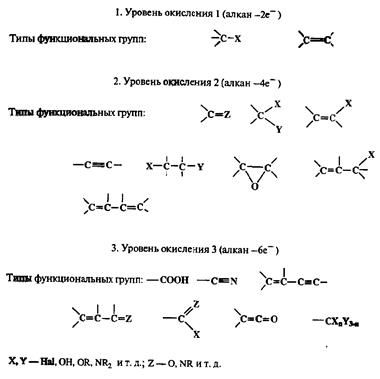 Схема 2.46
Схема 2.46
|
R-Hal + Mg → R-Mg-Hal
R-Mg-Hal + H2O → R-H + Mg(OH)Hal
Характеризуя в наиболее общем виде трансформационные переходы, отметим следующее:
1. Практически любые изогипсические трансформации легко осуществимы, так что взаимопревращения функциональных групп в пределах одного уровня окисления обычно не составляют проблемы.
2. Неизогипсичекие превращения осуществимы не для любых типов производных, а лишь для некоторых, особенно склонных претерпевать окисление или восстановление. Так. например, прямой переход от простых эфиров (уровень окисления 1) к ацеталям или кета-лям (уровень окисления 2) затруднен. Напротив, окисление спиртов в альдегиды или кетоны — это тривиальное превращение, равно как и обратный восстановительный переход. Приведем еще один пример: ацетилены легко превратить в олефины, в то время как аналогичный переход с уровня окисления 2 на уровень 1 для превращения дигалогеналканов в моногалогеналканы в общем случае затруднителен.
Таким образом напрашивается следующая аналогия: на каждом «этаже» (уровне окисления) можно свободно перемещаться из одной ячейки в другую. Напротив, перейти с «этажа» на «этаж» можно не в произвольном месте, а только предварительно добравшись до какого-либо «лифта», роль которого может выполнять далеко не каждая ячейка данного этажа. Такая картина при всей ее схематичности достаточно четко характеризует общие возможности и ограничения в использовании трансформаций функциональных групп. Это позволяет нам в дальнейшем изложении свести к минимуму рассмотрение конкретных реакций, обеспечивающих ту или иную трансформацию, и обратить внимание преимущественно на случаи, иллюстрирующие ограничения или, напротив, неочевидные возможности применения трансформаций функциональных групп в синтезе.
Дата добавления: 2015-04-05; просмотров: 1611;
