Карбометаллирование алкинов
Изложенные выше принципы проведения нуклеофильного присоединения по кратным связям как последовательности независимых стадий атаки нуклеофила и взаимодействия образующегося карбанионного интермедиата с добавляемым извне электрофилом применимы не только для реакций с субстратами типа акцепторов Михаэля. Одним из самых эффектных примеров, иллюстрирующих общность такого подхода и плодотворность его синтетического использования, является карбометаллирование алкинов, разработанное Норманом [16а].
В своей основе этот метод представляет собой один из вариантов давно известной реакции нуклеофильного присоединения по тройной связи, которая особенно часто использовалась для получения виниловых эфиров или винилсульфидов взаимодействием спиртов или меркаптанов соответственно с терминальными ацетиленами в присутствии оснований. Естественно, что в такой реакции невозможно было использовать в качестве нуклеофилов кар-банионные производные типа литий- или магнийорганических соединений, ибоединственным результатом реакции последних с терминальными ацетиленами бьшо образование соответствующих ацетиленидов лития или магния (из-за повышенной кислотности ацетиленового протона). В методе Нормана в качестве эквивалентов карбанионов используются купратные реагенты, низкая основность которых исключает возможность упомянутого осложнения. Непосредственным результатом присоединения этих реагентов по тройной связи является образование интермедиатов карбанионного типа, а именно винилкупратов. Последние достаточно стабильны в растворе и могут далее реагировать с широким кругом различных электрофилов, таких, как СО2, алкилгалогениды, эпоксиды, альдегиды, ос,р-ненасышенные кетоны и т. д. Конечным итогом последовательности эгих двух независимых химических событий — присоединения С-нуклеофила и С-электрофила по тройной связи — является образование соответствующего алкена.
Так, например, присоединение литийкупратного реагента 101(схема 2.32) по тройной связи ацетилена образует винилкупратный интермедиат 102.Обработка последнего электрофилом 103дает в качестве конечного продукта ацетоксидиен 104,активный компонент феромона бабочки древоточца Cossus cossus [16b].
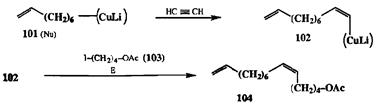 Схема 2.32
Схема 2.32
|
Сама схема проведения карбометаллирования по Норману, показанная на примере синтеза 104,допускает возможность независимой вариации природы всех трех компонент сочетания, т. е. исходного алкина, метапло-органического нуклеофила и электрофила. Благодаря этой особенности удалось разработать совершенно новый и унифицированный протокол для синтеза алкеновых производных по схеме сборки из трех простых предшественников, проводимой в одной колбе [15с, 16а]. Помимо общности этого метода, его примечательной особенностью является исключительно высокая степень стереоселективности превращения: наблюдается практически полное «<ис-присоединение аддендов по исходной тройной связи. Так, для феромона 104,полученного по показанной схеме, стсреоизомерная чистота составила 99,9%! Особое значение это имеет для синтеза феромонов, поскольку известно, что биологическая активность этих регуляторов очень сильно зависит от их стереохимической чистоты, и во многих случаях было обнаружено, что наличие даже ничтожного количества примеси альтернативного стереоизомера (< 0,5%) резко снижает активность полученного препарата.
Продуктами карбометаллирования монозамещенных ацетиленов по Норману являются алкены с трехзамещенной двойной связью, причем и в этих случаях обеспечивается практически полная регио- и стереоселективность (исключительное *<ыс-присоединение) [16с]. Отметим, что до разработки этого метода практически не существовало общего способа стереоселектив-ного синтеза трехзамещенных алкенов. Эффективность такого подхода хорошо иллюстрируется показанным на схеме 2.33 полным синтезом фараналя (105)[16d], метчика следа муравьев Monomoriumpharaonis.
 Схема 2.33
Схема 2.33
|
Ключевой стадией показанной схемы является стереоспешфическая сборка С9-кетона 106из трех простейших предшественников: метилацетиле-на (С3), этилмагнийбромида (С2) и метилвинилкетона (С4) (90). Последующее взаимодействие 106с фосфораном 107по реакции Виттига приводит к продукту 108,который уже содержит полный углеродный скелет синтезируемого соединения 105.Завершение синтеза последнего включает еще ряд очевидных стадий трансформации карбоксилатного заместителя.
В контексте обсуждаемого в данном разделе материала кажется уместным еще раз подчеркнуть то принципиальное значение, которое может иметь разработка новых реагентов и методов проведения даже хорошо известных реакций. Так, введение в синтетическую практику купратной модификации давно известных литий- или магнийорганических реагентов открыло совершенно новые перспективы для использования в синтезе целого ряда таких классических реакций, как сочетание по Вюрцу, присоединение по Михаэлю или нуклеофильное присоединение по тройной связи.
Дата добавления: 2015-04-05; просмотров: 1217;
