Закон действующих масс. Константа равновесия для газофазных реакций.
Допустим, что между газообразными веществами А1, А2 … Аi, А’1, А’2 … А’i протекает химически обратимая реакция по уравнению:
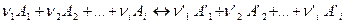
Химическая реакция протекает самопроизвольно до тех пор, пока не достигнуто химическое равновесие между реагирующими веществами. Химическое равновесие является динамическим равновесием, при котором скорости прямой и обратной реакций равны.
Состояние химического равновесия определяется двумя признаками:
- если система находится в состоянии равновесия, то ее состав с течением времени при постоянных внешних условиях не изменяется
- если система, находящаяся в равновесии, будет выведена из этого состояния вследствие внешних воздействий, то с прекращением их действия она возвратится в исходное состояние.
При практическом определении равновесия химических реакций, протекающих сравнительно быстро, часто руководствуются только первым признаком.
Однако, постоянство состава системы, в которой реакция протекает очень медленно, может быть только кажущимся, и на этом основании нельзя делать вывод о том, что система находится в состоянии химического равновесия. Примером может служить медленная реакция между водородом и кислородом при низких температурах. Любая смесь водорода, кислорода и водяных паров при низких температурах может оставаться неизменной в течение очень длительного промежутка времени, но достаточно определенного воздействия извне (например, введения платинового катализатора), чтобы вещества, входящие в состав смеси, прореагировали между собой. При прекращении внешнего воздействия рассматриваемая система уже не вернется в исходное состояние, так как до этого она не находилась в состоянии устойчивого равновесия.
При установлении в системе химического равновесия согласно (IV, 11)
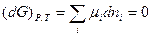
Подстановка выражения для 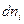 из уравнения (I, 55) для равновесного процесса приводит к соотношению:
из уравнения (I, 55) для равновесного процесса приводит к соотношению:
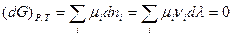
Из этого следует, что 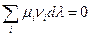
Так как химическая реакция протекала, то 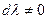 . Следовательно,
. Следовательно,
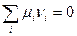 (V,1)
(V,1)
Напомним, что в последнем выражении слагаемые для исходных веществ должны быть взяты со знаком «-», а для продуктов реакции - со знаком «+».
Подстановка в уравнение (V,1) выражения для химического потенциала из (III, 46) дает
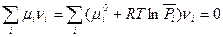
Тогда
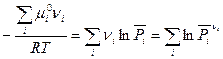 (V,2)
(V,2)
В результате потенцирования уравнения (V,2) будем иметь
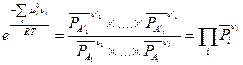 (V,3)
(V,3)
Так как стандартный химический потенциал 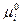 зависит только от природы индивидуального i –ого реагента и температуры, то при T = const левая часть в уравнении (V,3) является постоянной величиной и называется стандартной константой равновесия реакции К0.
зависит только от природы индивидуального i –ого реагента и температуры, то при T = const левая часть в уравнении (V,3) является постоянной величиной и называется стандартной константой равновесия реакции К0.
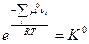 (V,4)
(V,4)
Стандартная константа равновесия является безразмерной величиной.
В соответствии с (V,3) для системы, компоненты которой подчиняются законам идеального газа, можно получить:
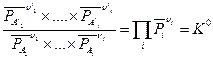 (V,5)
(V,5)
Уравнение (V,5) называется законом действующих масс.
Если исходить из уравнения (III, 48), определяющего химический потенциал через мольные доли, то выражение (V,1) можно записать в следующем виде:
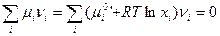
Тогда тем же путем можно вывести закон действующих масс в ином виде:
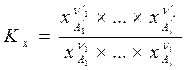 ,
,
Где 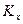 - константа равновесия, выраженная через мольные доли. В связи с тем, что
- константа равновесия, выраженная через мольные доли. В связи с тем, что 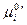 в уравнении (III, 48) зависит не только от температуры, но и давления,
в уравнении (III, 48) зависит не только от температуры, но и давления, 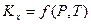 .
.
Закон действующих масс для газофазных реакций также часто записывается еще в двух формах:
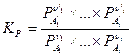 и
и
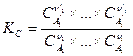 ,
,
где 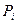 - парциальное давление и
- парциальное давление и 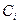 - концентрация i –ого компонента в равновесной газовой смеси.
- концентрация i –ого компонента в равновесной газовой смеси.
Отметим, что константы 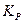 и
и 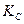 являются в общем случае размерными величинами.
являются в общем случае размерными величинами.
Соотношение между константами 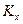 ,
, 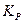 и
и 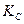 легко найти, если принять во внимание следующие соотношения:
легко найти, если принять во внимание следующие соотношения:
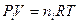
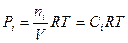 и
и
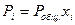
Тогда
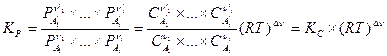 и
и

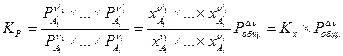 или
или
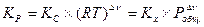 , (V,5а)
, (V,5а)
где 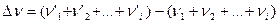
Очевидно, что 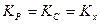 при условии, что число моль реагирующих веществ в ходе реакции не меняется, то есть, если
при условии, что число моль реагирующих веществ в ходе реакции не меняется, то есть, если 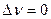 .
.
Дата добавления: 2015-05-21; просмотров: 2087;
