Уравнение изотермы химической реакции.
Предположим, в смеси идеальных газов протекает химическая реакция по уравнению
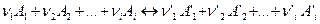
Допустим, что в момент приготовления реакционной смеси в ней присутствуют все реагирующие вещества. Обозначим исходные (неравновесные) относительные парциальные давления реагентов в системе через  для того, чтобы отличать их от равновесных относительных парциальных давлений тех же реагентов.
для того, чтобы отличать их от равновесных относительных парциальных давлений тех же реагентов.
В очередной раз воспользуемся уравнением (IV, 11):
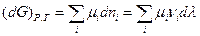
Разделив обе части уравнения на  , получим:
, получим:
 (V,6)
(V,6)
Если смесь компонентов с неравновесными парциальными давлениями всех участников реакции  имеет настолько большую массу, что изменение количества компонентов в результате одного пробега реакции практически не изменит их парциальных давлений, то в уравнении (V,6) можно заменить величину
имеет настолько большую массу, что изменение количества компонентов в результате одного пробега реакции практически не изменит их парциальных давлений, то в уравнении (V,6) можно заменить величину 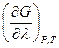 равной ей величиной
равной ей величиной  .
.
Положив  (реакция совершила один пробег), с учетом (III, 46) получим:
(реакция совершила один пробег), с учетом (III, 46) получим:
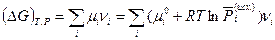 (V,7)
(V,7)
Уравнение (V,7) преобразуем к виду
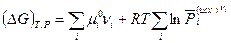
Так как  (смотри (V,4)), то
(смотри (V,4)), то
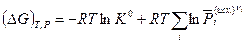 (V,8)
(V,8)
В этом уравнении 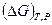 - изменение энергии Гиббса системы при химическом превращении такого числа молей реагирующих веществ, которое соответствует стехиометрическому уравнению реакции. Величина
- изменение энергии Гиббса системы при химическом превращении такого числа молей реагирующих веществ, которое соответствует стехиометрическому уравнению реакции. Величина 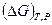 называется изменением энергии Гиббса химической реакции. Уравнение (V,8) впервые было выведено Вант-Гоффом и называется уравнением изотермы реакции.
называется изменением энергии Гиббса химической реакции. Уравнение (V,8) впервые было выведено Вант-Гоффом и называется уравнением изотермы реакции.
Ниже приводится развернутая форма уравнения (V,8):
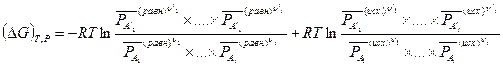
Следующая тождественная форма записи уравнения (V,8) является наиболее распространенной:
 (V,9)
(V,9)
Уравнение (V,9) позволяет вычислить изменение энергии Гиббса, а также предсказать направление протекания реакции при заданных условиях, если известны относительные парциальные давления реагирующих веществ в момент их смешения и стандартная константа равновесия. Константа равновесия 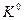 может быть вычислена на основании равновесного состава реакционной смеси или по третьему закону термодинамики.
может быть вычислена на основании равновесного состава реакционной смеси или по третьему закону термодинамики.
Итак, чтобы ответить на вопрос о возможности самопроизвольного протекания химической реакции в закрытой системе слева направо или справа налево, необходимо знать состав реакционной смеси в момент ее приготовления и стандартную константу равновесия при данной температуре.
Если в момент смешения относительные парциальные давления каждого реагента равны единице (все вещества вступают в реакцию в своих стандартных состояниях), то уравнение (V,9) запишется в виде:
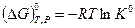 (V,10)
(V,10)
Величина 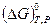 - стандартное изменение энергии Гиббса химической реакции.
- стандартное изменение энергии Гиббса химической реакции.
Смысл величин 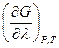 и
и 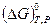 можно уяснить с помощью следующей схемы. На рис.8 изображена в общей форме зависимость величины
можно уяснить с помощью следующей схемы. На рис.8 изображена в общей форме зависимость величины 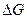 от
от 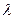 при изотермическом переходе от исходных веществ (их суммарную энергию Гиббса обозначим
при изотермическом переходе от исходных веществ (их суммарную энергию Гиббса обозначим 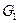 ) к продуктам реакции (
) к продуктам реакции (  ). Величина
). Величина  может быть меньше величины
может быть меньше величины  , когда продукты реакции более устойчивы, чем смесь исходных веществ. Возможен и обратный случай.
, когда продукты реакции более устойчивы, чем смесь исходных веществ. Возможен и обратный случай.

Рис.8. Зависимость величины G от химической постоянной λ
В начальном состоянии парциальные давления продуктов реакции равны нулю, в конечном состоянии парциальные давления исходных веществ равны нулю. В равновесной смеси при условии
0 < λ < 1 производная 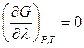 и касательная к кривой
и касательная к кривой  параллельна оси абсцисс. Величина
параллельна оси абсцисс. Величина 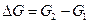 и
и 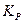 , связанная со значением
, связанная со значением 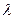 , определяющим состояние равновесия, взаимно и однозначно определяют друг друга.
, определяющим состояние равновесия, взаимно и однозначно определяют друг друга.
Чем больше величина  отличается от величины
отличается от величины  , тем ближе положение равновесия к одной из границ диаграммы. Чем больше сближаются величины
, тем ближе положение равновесия к одной из границ диаграммы. Чем больше сближаются величины  и
и  , тем ближе положение равновесия к середине диаграммы. Конкретный вид кривой зависит от стехиометрического типа реакции и разности
, тем ближе положение равновесия к середине диаграммы. Конкретный вид кривой зависит от стехиометрического типа реакции и разности 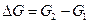 , т.е., от индивидуальных свойств участников реакции.
, т.е., от индивидуальных свойств участников реакции.
В каждой точке кривой  наклон касательной определяет значение
наклон касательной определяет значение 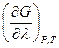 в смеси данного состава. Стандартное изменение энергии Гиббса химической реакции равно
в смеси данного состава. Стандартное изменение энергии Гиббса химической реакции равно  .
.
Реальный химический процесс всегда протекает так, что энергия Гиббса изменяется по кривой в направлении к ее минимуму. При этом в зависимости от исходного состава смеси это изменение идет по правой или левой (по отношению к экстремуму) части кривой.
Дата добавления: 2015-05-21; просмотров: 1384;
