Влияние концентрации на скорость химической реакции
Как известно из предыдущих глав, скорость реакции как прямой, так и обратной определяется изменением концентрации реагирующих веществ в единицу времени. Так, для реакции вида
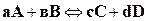
скорость прямой реакции 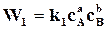 ,
,
а скорость обратной 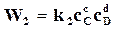 .
.
Концентрации исходных веществ в реакции будут уменьшаться, а полученных – возрастать. По мере израсходования исходных веществ скорость процесса, уменьшается, следовательно, численные значения скорости будут различными в различные промежутки времени.
Средняя скорость реакции обычно относится к конечному промежутку времени 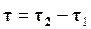
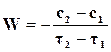 . (18.1)
. (18.1)
Истинную скорость можно определить как производную от концентрации по времени
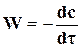 . (18.2)
. (18.2)
Знак «─» в выражениях (18.1) и (18.2) соответствует уменьшению концентрации исходных веществ со временем.
Для обратимых реакций, когда 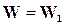 ─
─ 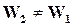 , реакции идут с неполным исчезновением исходных веществ. Скорость убывания концентрации исходного вещества В в бимолекулярной реакции вида
, реакции идут с неполным исчезновением исходных веществ. Скорость убывания концентрации исходного вещества В в бимолекулярной реакции вида
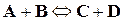 равна
равна 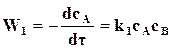 , (18.3)
, (18.3)
а скорость возрастания концентрации того же вещества А в результате обратной реакции
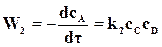 . (18.4)
. (18.4)
Уравнения скорости реакции 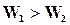 может быть записано в виде
может быть записано в виде
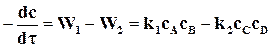 .
.
Состояние динамического равновесия наступает в результате равенства скоростей 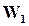 и
и 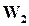 , при этом общая скорость реакции будет равна нулю.
, при этом общая скорость реакции будет равна нулю.
Следовательно, при равновесии
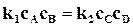 ,
, 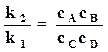 . (18.5)
. (18.5)
Правая часть этого равенства представляет собой константу равновесия 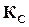 данной реакции и, следовательно,
данной реакции и, следовательно, 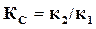 представляет собой отношение констант скоростей двух противоположных реакций, составляющих данную обратимую реакцию.
представляет собой отношение констант скоростей двух противоположных реакций, составляющих данную обратимую реакцию.
Если предположить, что в заданном объеме моли веществ, участвующих в бимолекулярной реакции, равны a, b,c,d и в определенный момент времени τ их количество равно (а ─ x), (b ─x), (с ─ x), (d ─ x), то
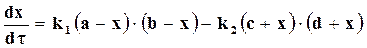 .
.
Допуская для простоты выводов, что a = b и c = d = 0, предыдущее уравнение перепишем в виде
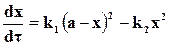 . (18.6)
. (18.6)
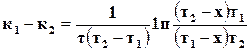 ,
,
где 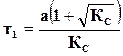 ,
, 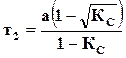 ,
, 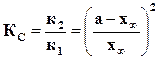 ,
,
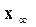 – количество прореагировавшего вещества к моменту равновесия.
– количество прореагировавшего вещества к моменту равновесия.
Дата добавления: 2015-04-03; просмотров: 1488;
