Влияние температуры на скорость химической реакции
Экспериментальные исследования химических реакций показывают, что при повышении температуры скорость реакции увеличивается. Так, например, скорость реакции соединения водорода с кислородом при температуре 300◦С неизмеримо мала; а при 700◦С эта реакция идет с громадной (взрывной) скоростью.
Количественная оценка влияния температуры на скорость реакции, а, следовательно, и на константу скорости оценивается температурным коэффициентом скорости реакции 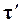 . Температурный коэффициент скорости равен отношению констант скоростей
. Температурный коэффициент скорости равен отношению констант скоростей
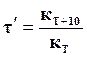 .
.
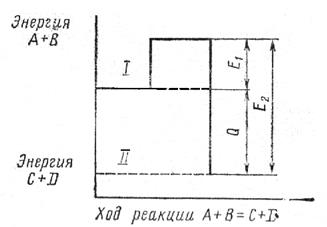 и показывает, во сколько раз увеличилась скорость реакции при увеличении температуры на 10градусов.
и показывает, во сколько раз увеличилась скорость реакции при увеличении температуры на 10градусов.
Рисунок 18.1 – Влияние энергии рассматриваемой системы молекул на горизонтальный ход реакции.
Опытными исследованиями установлено, что при повышении температуры на 10 градусов скорость гомогенных реакций увеличивается в 2-4 раза.
Уравнение вида 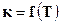 можно вывести из уравнения изохоры химической реакции (17.17)
можно вывести из уравнения изохоры химической реакции (17.17)
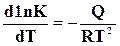 ,
,
которая выражает температурный коэффициент константы равновесия через тепловой эффект реакции. Но так как константа равновесия 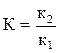 , то
, то
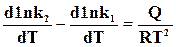 . (18.7)
. (18.7)
Рассмотрим тепловой эффект реакции как разность двух энергетических величин
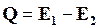 ,
,
где Е1 и Е2 относятся к прямой и обратной реакции.
На вертикальной оси (рисунок 18.1) отложена энергия рассматриваемой системы молекул на горизонтальный ход реакции. Если идет прямая экзотермическая реакция, т. е. из вещества А и В получаются вещества С и D, то общий запас энергии продуктов реакции меньше, чем исходных и система в результате переходит на более низкий энергетический уровень. Разность этих уровней равна теплоте реакцииQ. Верхний уровень определяет тот наименьший запас энергии, которым должны обладать молекулы, чтобы их столкновения могли привести к химическому взаимодействию. Разность между этим верхним уровнем и уровнем 1 представляет энергию активации прямой реакции Е1, а разность между максимальным уровнем и уровнем 2 – энергию активации обратной реакции Е2. Таким образом, в ходе реакции система должна перейти через энергетический барьер.
Уравнение (18.7) можно разложить на два, относящихся к прямой и обратной реакциям, и оно будет удовлетворено если
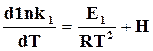 и
и 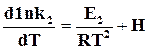 .
.
В общем случае 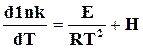 . (18.8)
. (18.8)
Это уравнение было выведено Вант-Гоффом.
На основании опытных данных можно принять Н=0, тогда уравнение (18.8) примет вид
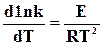 . (18.9)
. (18.9)
Интегрируя это уравнение при постоянной величине Е, получим
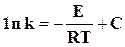 , (18.10)
, (18.10)
где С ─ константа интегрирования.
Откуда
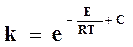 . (18.11)
. (18.11)
Это уравнение позволяет выразить зависимость константы скорости химической реакции от температуры в виде прямой в координатах 1п к, 1/Т.
Пользуясь уравнением (18.10), можно определить зависимость температурного коэффициента скорости реакции от температуры.
Для температур Т1 и Т2 получим
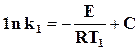 ,
, 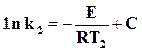 , или
, или
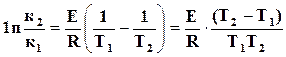 .
.
Принимая Т2=Т1+10; Т1Т2=Т2 ср и R=8,3143 кДж/(моль  град),
град),
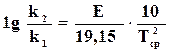 , (18.12)
, (18.12)
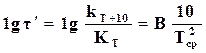 . (18.13)
. (18.13)
Откуда
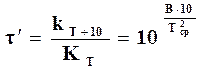 . (18.14)
. (18.14)
Полученная зависимость показывает, что 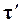 с повышением температуры уменьшается, т. е. с повышением температуры уменьшается рост константы скорости, следовательно, и рост скорости реакции. Скорость реакции при низких температурах возрастает более интенсивно, чем при высоких.
с повышением температуры уменьшается, т. е. с повышением температуры уменьшается рост константы скорости, следовательно, и рост скорости реакции. Скорость реакции при низких температурах возрастает более интенсивно, чем при высоких.
Дата добавления: 2015-04-03; просмотров: 1185;
