Активация. Химические реакции осуществляются в результате взаимных столкновений молекул
Химические реакции осуществляются в результате взаимных столкновений молекул. Скорость реакции на основании закона действующих масс зависит от концентрации реагирующих молекул, следовательно, и числа столкновений. Чем больше концентрация, тем больше будет столкновений. Однако в реакциях, протекающих с конечной скоростью, не все столкновения молекул приводят к химическому взаимодействию. Эффективными будут только те столкновения между молекулами, которые в момент столкновения обладают некоторым избытком внутренней энергии и при встрече их может выделиться энергия, необходимая для разрушения химических связей. Этот избыток энергии, необходимый для проведения данной реакции, называется энергией активации. Причина того, что топливо (бензин, керосин и т. п.) не загорается само собой, заключается в значительной энергии активации соответствующих окислительных реакций. Повышение температуры приводит к тому, что все чаще и чаще молекулы окислителя и горючего в момент столкновения имеют необходимый избыток энергии, в конце концов скорость реакции достигает большой величины – начинается горение. По теории активации к реакции могут привести только столкновения между активными молекулами, энергия которых будет больше энергии активации.
Когда число активных молекул 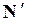 составляет относительно малую долю от их общего числа
составляет относительно малую долю от их общего числа 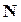 , то (на основании уравнения распределения Больцмана) отношение их равно
, то (на основании уравнения распределения Больцмана) отношение их равно
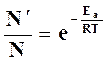 , (18.15)
, (18.15)
где Ea – некоторый минимум энергии молекул при столкновении.
В силу этого активное число столкновений, энергия которых превышает энергию активации Ea, равно
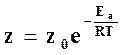 , (18.16)
, (18.16)
где z0 – полное число столкновений.
На основании уравнения (18.16) скорость химической реакции
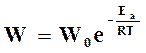 (18.17)
(18.17)
зависит как от температуры, так и от величины энергии активации.
Для бимолекулярной реакции скорость W0, соответствующая полному числу столкновений молекул равна
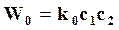 ,
,
где k0 – константа скорости по столкновению;
с1,с2 – концентрации реагентов.
Действительная скорость реакции на основании теории активации определяется по формуле
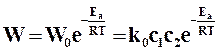 . (18.18)
. (18.18)
Обозначая величину 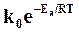 через k, получим
через k, получим
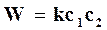 , (18.19)
, (18.19)
где k – действительная константа скорости химической реакции, которая учитывает фактор активации.
Выражение для действительной скорости реакции (18.19) имеет тот же вид, что и закон действующих масс, но учитывает фактор активации 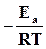 .
.
Дата добавления: 2015-04-03; просмотров: 1047;
