В ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
При разработке нового ХТП необходимо установить, какие реакции будут протекать при переработке данного сырья, каков будет максимальный выход продукта и какие будут скорости протекания процесса.
О протекании химической реакции судят по изменению изобарно-изотермического потенциала (энергии Гиббса). Известно, что при проведении химической реакции в изобарно-изотермических условиях самостоятельно, т.е. в сторону образования продукта, протекают реакции, сопровождающиеся уменьшением энергии Гиббса.
Энергия Гиббса может быть определена по уравнению Вант-Гоффа
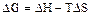 . (3.1)
. (3.1)
Проанализировав уравнение Вант-Гоффа, можно выделить следующее:
- когда химическая реакция протекает при небольшой температуре, множитель 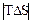 по абсолютной величине мал, и им можно пренебречь, т.е.
по абсолютной величине мал, и им можно пренебречь, т.е.
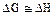 ; (3.2)
; (3.2)
- при высоких температурах можно пренебречь ∆Н, следовательно,
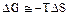 . (3.3)
. (3.3)
Эти приближенные равенства показывают, что при низких температурах критерием направления самопроизвольного процесса в первом приближении может служить знак теплового эффекта химической реакции; при высоких температурах – знак изменения энтропии. Это означает, что при низких температурах самопроизвольно протекают экзотермические реакции, а при высоких – реакции, сопровождающиеся ростом энтропии.
Отрицательное значение энергии Гиббса говорит о том, что реакция термодинамически возможна. В действительности она может не протекать, т.к. будет мала скорость химической реакции. Рассмотрим простую обратимую реакцию: аА + вВ 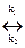 rR + sS.
rR + sS.
В условиях равновесия скорости
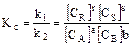 , (3.4)
, (3.4)
где Кс – константа равновесия.
Если реакция газофазная, то
| |
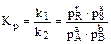 , (3.5)
, (3.5)
где рR, pS, pA, pB – парциальные давления продуктов и реагентов.
| |
Например:
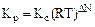 , (3.6)
, (3.6)
где 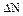 – изменение числа молей в ходе реакции.
– изменение числа молей в ходе реакции.
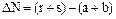 . (3.7)
. (3.7)
Условия равновесия будут определяться температурой, давлением и концентрацией реагирующих веществ.
Дата добавления: 2015-06-17; просмотров: 945;
