Сдвиг равновесия под влиянием реагирующих веществ
Для газофазной реакции СО+Н2О↔ СО2+Н2
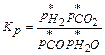 , (3.15)
, (3.15)
где р* – парциальные давления реагентов и продуктов.
При условии, когда Kp = const и T = const:
- если увеличить знаменатель, то возрастет и числитель, следовательно, возрастает концентрация продуктов реакции;
- если уменьшить числитель, то уменьшится и знаменатель, следовательно, увеличится степень переработки сырья.
На практике используют оба эти метода. Для увеличения концентрации водорода в систему вводится негашеная известь, которая реагирует с углекислым газом, тем самым возрастает парциальное давление водорода: СаО+СО2= СаСО3.
Введение водоотнимающих веществ (Н2SO4) позволяет смещать равновесие реакции вправо в реакциях этерификации
СН3СООН+НОСН3↔СН3СООСН3+Н2О.
Введение избытка кислорода О2 смещает равновесие вправо в реакции
SO2+1/2O2↔SO3.
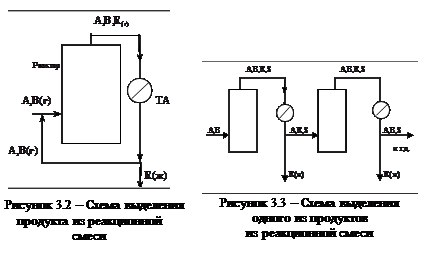
На практике достаточно часто используется метод, заключающийся в изменении агрегатного состояния продукта и выводе его из системы; причем работа установок организована по циклическому методу (рисунок 3.2). Если продуктов несколько, то схема выглядит иначе (рисунок 3.3).
Химическая термодинамика показывает, какие реакции будут протекать в системе и какие предельные равновесные концентрации будут достижимы. Для организации ХТП необходимо, чтобы была большая скорость реакции, т.к. она определяет интенсивность процесса.
Дата добавления: 2015-06-17; просмотров: 767;
