Основные тенденции развития химической технологии
Совершенствование ХТ направлено на повышение производительности труда, улучшение качества выпускаемой продукции и снижение себестоимости.
Главные направления развития ХТ:
- увеличение мощностей химико-технологических систем и отдельных аппаратов;
- интенсификация работы аппаратов;
- механизация трудоемких процессов;
- комплексная автоматизация отдельных производств с применением ЭВМ;
- замена периодических производств на непрерывные;
- снижение энергозатрат и рациональное использование теплоты химической реакции;
- уменьшение стадий производства и переход к замкнутым системам;
- создание безотходных производств.
Иерархическая структура химического производства представлены на рисунке 1.1
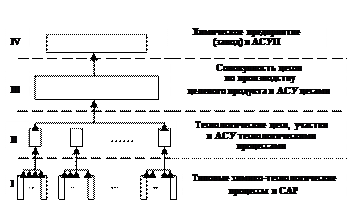
АСУП – автоматизированная система управления предприятием;
АСУ – автоматизированная система управления;
САР – система автоматического регулирования:
Рисунок 1.1 – Иерархическая структура
химического производства
Химико-технологический процесс и его содержание
Химико-технологический процесс (ХТП) – это совокупность операций, позволяющих получить целевой продукт из исходного сырья.
Он состоит:
- из подготовки сырья;
- химической или физико-химической переработки сырья;
- обработки готовой продукции.
Вторую операцию можно подразделить на элементарные стадии:
- подвод реагентов в зону химической реакции;
- химическую реакцию;
- отвод продуктов из зоны химической реакции.
В ХТ используется более ста тысяч реакций, и их классифицируют следующим образом (рисунки 1.2, 1.3, 1.4, 1.5, 1.6, 1.7, 1.8).

Рисунок 1.2 – Классификация химических реакций
Формально все реакции являются обратимыми, но у многих реакций скорость обратной реакции настолько мала, что их можно считать условно необратимыми.

Рисунок 1.3 – Классификация химических реакций по фазовому
составу
Гомогенные реакции – это реакции, где все участники химической реакции находятся в одной фазе.
Гетерогенные реакции – это реакции, где один из участников химической реакции находится в другой фазе.
Участниками химической реакции являются реагенты, продукты, катализаторы.
Например: 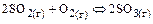 – реакция гетерогенно-каталитическая, т.к. протекает на ванадиевой контактной массе.
– реакция гетерогенно-каталитическая, т.к. протекает на ванадиевой контактной массе.
Простыми реакциями называют реакции, для осуществления которых требуется преодоление лишь одного энергетического барьера (одна стадия).
Cложные реакции включают в себя несколько параллельных или последовательных стадий (простых реакций).
Реальные одностадийные реакции встречаются чрезвычайно редко. Однако некоторые сложные реакции, проходящие через ряд промежуточных стадий, удобно считать формально простыми. Это возможно в тех случаях, когда промежуточные продукты реакции в условиях рассматриваемой задачи не обнаруживаются.

Рисунок 1.4 – Классификация химических реакций
по механизму осуществления реакции
Классификация по молекулярности учитывает, сколько молекул участвует в элементарном акте химической реакции. Столкновение трех молекул уже маловероятно, следовательно, если в реакции участвует более трех молекул, то реакция протекает более сложно в несколько стадий.

Рисунок 1.5 – Классификация химических реакций по
молекулярностям

|
|
|
| |
 Порядок реакции – это сумма показателей степеней у концентраций реагентов в кинетическом уравнении.
Порядок реакции – это сумма показателей степеней у концентраций реагентов в кинетическом уравнении.
Рассмотрим простую необратимую реакцию:
aA + bB = rR + sS;
WrA=k (CA)a · (CB)b.
Порядок реакции: n = a + b.
Молекулярность: µ = a + b.

Рисунок 1.6 – Классификация химических реакций по порядку
Порядок и молекулярность не всегда совпадают:
- если реакция каталитическая, то порядок реакции меньше молекулярности (как правило, дробный);
- если один из реагентов подан в избытке, то его концентрация практически не меняется и, следовательно, меняется кинетическое уравнение.
Если А в избытке, то WrA = k' · (CB)b;
n = b, µ = a+ b.
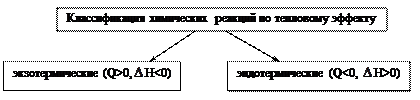
Рисунок 1.7 – Классификация химических реакций по тепловому
эффекту
Катализаторы – это вещества, которые многократно вступают в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции; при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий.

Рисунок 1.8 – Классификация химических реакций
по использованию катализатора
Дата добавления: 2015-06-17; просмотров: 2688;
