Закон Рауля.
Обширные экспериментальные исследования Франсуа Мари Рауля (1886 г.) обнаружили, что в типичных случаях давление насыщенного пара растворителя над раствором (Р) равно его давлению над чистым растворителем (Р0), умноженному на мольную долю растворителя (N0) в растворе:
Р = Р0 N0. (7.1)
Из (7.1) следует, что Р < Р0, так как N0 < 1. Уменьшение давления насыщенного пара над раствором может быть объяснено уменьшением поверхности испарения при добавлении растворяемого вещества.
Закон Рауля часто применяется в другой, более удобной для практического использования форме. Для этого правая и левая часть (7.1) делится на Р0 и из обоих частей вычитается единица:
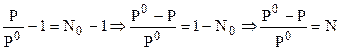 , (7.2)
, (7.2)
где N - молярная доля растворенного вещества.
Из выражения (7.2) следует, что относительное понижение давления насыщенного пара растворителя над раствором, равно молярной доле растворенного вещества.
На практике большинство растворов обнаруживают более или менее значительные отклонения от закона Рауля, растущие с увеличением концентрации.
Растворы, в которых поведение растворенного вещества и растворителя подчиняются закону Рауля называются абсолютно идеальными или совершенными. Для этих растворов закон Рауля справедлив для любых концентраций растворителя и растворенного вещества. Такие растворы образуют вещества с близкими физическими свойствами и, как следствие, при отсутствии взаимодействия частиц растворителя и растворенного вещества.
Например, если компоненты совершенного раствора А, В, то справедливо соотношение:
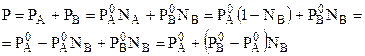 , (7.3)
, (7.3)
где РА, РВ - давления насыщенных паров компонентов над раствором;
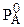 ,
, 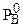 - давления насыщенных паров компонентов над чистыми компонентами;
- давления насыщенных паров компонентов над чистыми компонентами;
NA, NB - мольные доли компонентов.
Из (7.3) следует, что давление паров над раствором (Р) линейно изменяется с изменением состава раствора.
Дата добавления: 2015-05-21; просмотров: 1208;
