Направление реакций и условие равновесия.
Если начальные парциальные давления или концентрации реагирующих газов совпадают с равновесными, то 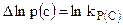 и AP(V) = 0. Это означает, что в состоянии равновесия реакция не идет и система не работает.
и AP(V) = 0. Это означает, что в состоянии равновесия реакция не идет и система не работает.
Чем более далеки парциальные давления или концентрации реагентов от равновесных, тем больше величина работы, выше сродство, как это следует из уравнения изотермы химической реакции. Согласно этому же уравнению реакция идет в направлении, указанном ее уравнением, если 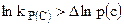 . При этом AP(V) > 0, т. е. система сама совершает работу.
. При этом AP(V) > 0, т. е. система сама совершает работу.
Реакция пойдет в обратном направлении, если 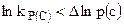 .
.
Чем больше АР(V), тем больше kP(C) и тем дальше пойдет реакция при заданных начальных парциальных давлениях (или концентрациях), так как большим kP(C) отвечают большие значения равновесных концентраций конечных продуктов реакции (числитель) и малые равновесные концентрации остающихся исходных продуктов реакции (знаменатель). Поэтому очевидно, что константа равновесия химической реакции однозначно определяет полноту протекания химической реакции.
Дата добавления: 2015-05-21; просмотров: 693;
