ТОЛСТОГО ФИЛАМЕНТА: МИОЗИН
Толстым филаментом является миозин (см. рис. 3.2). Его диаметр примерно 10-15 нм, а длина — около 1,5 мкм. Таким образом, он более плотный (толстый) и более короткий, чем актиновый филамент. Уникальность миозиновых филаментов заключается в том, что они имеют множество латеральных отростков, которые простираются по направлению к актиновым филаментам. Эти отростки называются поперечными мостиками. Они являются участками связывания актино-вых и миозиновых филаментов, в результате чего образуется мышечное напряжение.
Миозиновая головка. Исследования показывают, что НММ может также расщепляться на два субфрагмента: S-1 и S-2. Субфрагмент S-2 является сегментом миозинового стержня, расположенного между головкой и дистальным сегментом стержня. С другой стороны, субфрагмент S-1 является сегментом молекулы миозина, составляющей головку. Он состоит из легких и тяжелых цепочек. Каждый сегмент тяжелой цепочки, находящийся в пределах головки, делится на три фракции. Функциональное значение этого деления пока еще не выяснено. Кроме тяжелой цепочки, каждая головка содержит две, иногда три легкие цепочки. Результаты исследований показывают, что эти легкие цепочки играют роль в молекулярном привязывании и руководстве головками (Chowrashi и др., 1989).
Миозиновый хвост. При тщательном анализе миозиновой молекулы можно увидеть, что она состоит из двух частей: хвоста и головки (см. рис. 3.2). Хвост нередко называют стержнем или участком стержня миозиновой молекулы. Этот сегмент молекулы миозина, состоящий из дисталь-ного конца миозинового стержня, также называют легким меромиозином (ЛММ). К нему присоединен тяжелый меромиозин (ТММ). Этот компонент молекулы миозина включает в себя проксимальный сегмент стержня и головку. В отличие от ЛММ, ТММ обладает способностью связываться с актином.
Наука о гибкости
 УЛЬТРАСТРУКТУРА
УЛЬТРАСТРУКТУРА
СОЕДИНИТЕЛЬНОГО ФИЛАМЕНТА:
ТИТИН
Согласно современной модели двухфиламентного саркомера, предложенной X. Хаксли и Хенсоном (1954), а также А. Хаксли и Нидергерке (1954), сокращение мышцы происходит благодаря связыванию и движению филаментов актина и миозина. Два филамента двигаются или скользят относительно друг друга, изменяя степень взаимного перекрытия, тогда как их длина не изменяется. Однако, если взглянуть на классическую иллюстрацию организации саркомера (см. рис. 3.2), возникают следующие вопросы:
• во-первых, почему создается впечатление, что филаменты миозина
плывут?
• во-вторых, что удерживает саркомер воедино?
Структура саркомера кажется полностью нелогичной. Неизменной особенностью мышцы является центральное положение миозина в сарко-мере, посередине между Z-линиями. Это положение сохраняется даже при растяжении саркомера.
Что же удерживает миозин в центре? Ответом на этот вопрос является наличие соединительного филамента — титина (рис. 3.4 и 3.5).
До начала 1990-х гг, в большинстве учебников по физиологии, гистологии и даже анатомии об этих филаментах почти не упоминалось. По мнению Маруямы (1986), это объяснялось тем, что они не очень четко вписывались в теорию скольжения филаментов.
Структура титина.Спустя несколько лет после идентификации соединительных филаментов Ванг (1985) приступил к тщательному биохимическому анализу белка коннектин. Исследования показали, что коннектин состоит из двух белков: титина и небулина.
На сегодняшний день титин является наиболее крупным белком, его молекулярная масса равна 2,5-3,0 Da (Maruyama и др., 1984; Kurzban и Wang, 1988). Титин составляет около 10 % миофибриллярной массы (Trinick, Knight, Whiting, 1984; Wang, Ramirez-Mitchell, Palter, 1984).

|
Соединительный
филамент
(титин)
Толстый филамент (миозин)
Тонкий филамент (актин)
Рис. 3.4. Схематическая диаграмма, иллюстрирующая расположение основных структурных элементов саркомера (Pollack, 1990)
Глава 3 Сократительные компоненты мышцы






 ОТКРЫТИЕ ТИТИНА
ОТКРЫТИЕ ТИТИНА
| Тонкий фил;1мент ™ &-ЛИНИЯ |
| Толстый фгошмевт |
|
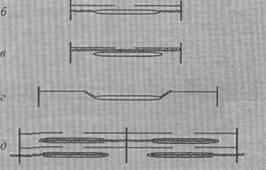
Открытие титина имеет длинную историю. Первая трехфила-ментная модель, включавшая эластичный филамент, была предложена X. Хаксли и Хенсоном (1954; рис. 3.5, а). Они высказали предпо- ложение о существовании S-филаментов — тонких растяжимых фи-лзментов, соединяющих концы филаментов актина. Однако они не, включили S-филамент в свою модель capкомepa~(Page и. Huxley, 1963). Спустя несколько лет А. Хаксли и Пичи (1961; рис. 3.5, г) упомянули в своем исследовании возможное присутствие «тонких филаментов», соединяющих концы филаментов миозина и актина. В том" же году Карлсен, Кнаппельс и Бухталь (1961) сообщили о том, что наблюдали филаментные структуры в «щелевом пространстве» меж-ду сильно растянутыми филаментами актина и миозина. В 1962 очень тонкие филаменты также наблюдал Сйостреод в «щелевом31 участке» между филаментами актина и миозина при экстремальном" растяжении мышцы. Он назвал их «щелевыми филаментами» и выс- казал предположение, что они связаны с концами миозиновых фила- ментов. Пейдж и Хаксли (1963) подтвердили это предположение. В это же время Обер и Куто(1962Г 1963; рис 3.5, б), изучая мыш-цьт насекомых, показали, что филаменты мнозина связываются с-Z-линиями при помощи отличного от филаментов актина. Чуть позже Принт (1967) назвал его «С-филаментом». Приблизительно в тоже самое время Мак-Нил и Хоул (1967; рис. 3.5, в) выявили, на фотогра-фиях наличие «супертонких» филаментов, идущих параллельно тон-ким и толстым филаментам, они назвали их «Т-филаментами». Похожие результаты были опубликованы Уолкоттом и Риджвеем (1967).' . Наконец, в 1968 г. состоялся симпозиум, посвященный мьщцам котором обсуждались различные трехфиламентные модели, однако к единому - мнению ученые так и не пришли (Wang, 1984).
. В середине 1970-х годов был проведен целый ряд очень интересных исследований (Locker. Leet, 1975, 1976а, 19766; Locker, Daines, Leet, 1976), в -которых подробно анализировалось, поведение «щелевых филаментов» в сильно растянутой мышце быка. Вскоре эти филаметы стали известны как
рис35. Схематические диаграммы ряда моделей „меты стали известны как саркомеров с тремя филаментами (Wang,1985) .
Наука о гибкости
 | ||||
 | ||||
 |

|
 Тонкие Щель филамешы
Тонкие Щель филамешы
Толстые филаменты - [-полоса -
Щель

 Ряс. 3.6. Непосредственное доказательство наличия соединителышх филаментов в
Ряс. 3.6. Непосредственное доказательство наличия соединителышх филаментов в
летательной мышае рабочей пчелы <а). Примеры филаментов коннектина (титина)
в сильно растянутой мышце лягушки Id). Изображение замороженной летательной
мышцы рабочей пчелы (в) (Pollack, 1990)
 30
30
 Г л ав а 3 ■ Сотфатительныв компоненты мышцы
Г л ав а 3 ■ Сотфатительныв компоненты мышцы

 «G-филаменты» (рис. 3.5, д). На рис. 3.6 представлены фотографии, иллюстрирующие наличие этих соединительных филаментов. Во время фиксаций тонкие филаменты были деполимеризованы и смы-. ты. Соединительные филаменты остались нетронутыми и видимыми стрелка) (рис. 3.6, а). Толстые филаменты (в центре) не заканчиваг ются; они «уступают» место более тонким «соединительным» фнла-Рментам (стрелки), которые простираются до Z-линии. Концы тонких • филаментов, видимые по краям рисунка, не накладываются на.тон--; стые филаменты"(рис. 3.6, б). Тонкие филаменты удалились от 2,-ли-нии (стрелка). Соединительные филаменты видны в I-диске (стрелка) (рис. 3.6, в)
«G-филаменты» (рис. 3.5, д). На рис. 3.6 представлены фотографии, иллюстрирующие наличие этих соединительных филаментов. Во время фиксаций тонкие филаменты были деполимеризованы и смы-. ты. Соединительные филаменты остались нетронутыми и видимыми стрелка) (рис. 3.6, а). Толстые филаменты (в центре) не заканчиваг ются; они «уступают» место более тонким «соединительным» фнла-Рментам (стрелки), которые простираются до Z-линии. Концы тонких • филаментов, видимые по краям рисунка, не накладываются на.тон--; стые филаменты"(рис. 3.6, б). Тонкие филаменты удалились от 2,-ли-нии (стрелка). Соединительные филаменты видны в I-диске (стрелка) (рис. 3.6, в)
В 1976 г, Маруяма, Натори иНономура приступили к изучению
эластичности мышц. Им удалось отделить эластичный белок от мио-
фябрлл, который явно отличался от эластина и коллагена. -Маруяма:
- (1976) предложил назвать внутриклеточный эластичный белок кои-
нектином,. Спустя год было установлено, что структура коннектина
обусловливает механическую непрерывность и передачу напряжения"
поперечнополосатой мышце (Maruyama и др., 1977).
Ванг, Эш и Сингер (1975) предприняли попытку выявить белок иламента гладкой мышцы в поперечнополосатой мышце."Однако овершённо случайно Ванг обнаружил три белка с высокой молеку-рной массой. Ванг, Мак-Клур и Ту (1979) назвали этот белок тити-гам.Вскоре Мдруяма с коллегами (19S1) подтвердили, что титин Ванга идентичен коянектину. Таким образом, спустя почти 20 лет исследований третий филамент саркомера был идентифицирован. Ис- -следования показывают, что каждая молекула титина простирается от Z-линии (конец саркомера) до М-линии (центр саркомера) (Fiurst'H др., 1988; Itoh и др, 1988; Wang, Wright, Ramirez-Mitchell, 1985; Whiting, Wardale, Trtnick, 1989). Кроме того, результаты указанных-выше исследований показали, что участок А-диска титина тесно при- -вязан к "толстому филаменту. Поэтому при растяжении саркомера участок молекулы титина, расположенный в А-диске, ведет себя так, будта он прочно прикреплен к толстым филаментам. Участок молекулы'титина, связанный с Z-линиями, проявляет эластичность-Именно эта эластичность является решающим фактором в.нашем понимании сущности гибкости.
 Что делает титиновый филамент столь эластичным?Теоретически ряд факторов обусловливают существенную растяжимость титина. Во-первых, титин содержит большое количество аминокислоты пролин, которая расщепляет а-спиралевидные цепочки, обусловливающие ригидность полипептидов (Pollack, 1990). Во-вторых, как следствие этого, отдельная молекула титина не содержит никакой а-спиралевидной структуры. Наоборот, она состоит из произвольных витков (Trinick, Knight,
Что делает титиновый филамент столь эластичным?Теоретически ряд факторов обусловливают существенную растяжимость титина. Во-первых, титин содержит большое количество аминокислоты пролин, которая расщепляет а-спиралевидные цепочки, обусловливающие ригидность полипептидов (Pollack, 1990). Во-вторых, как следствие этого, отдельная молекула титина не содержит никакой а-спиралевидной структуры. Наоборот, она состоит из произвольных витков (Trinick, Knight,
Наука о гибкости
 Whiting, 1984). В-третьих, отдельный пептид с молекулярной массой, равной 3 млн Da, может достигать длины до 7,0 мкм. В то же время в покое длина саркомера составляет около 2,4 мкм, а при максимальном растягивании — 7,0 мкм. На основании этих данных было высказано предположение, что титин должен быть компактно «упакован» в саркомере (Maruyama, 1986). Таким образом, в случае начального растягивания мышцы сегмент титина, находящийся между концом миозинового фила-мента и Z-линией, является главным фактором, обусловливающим увеличение длины саркомера (Trombitas и др., )993). После того как этот сегмент титина достигнет предела своей длины, рекрутирование дополнительных «завернутых» (скрученных) или каким-то образом прикрепленных к филаменту миозина сегментов титина обусловливает дальнейшее увеличение длины саркомера (Wang и др., 1991). Однако и эта структура имеет свои пределы.
Whiting, 1984). В-третьих, отдельный пептид с молекулярной массой, равной 3 млн Da, может достигать длины до 7,0 мкм. В то же время в покое длина саркомера составляет около 2,4 мкм, а при максимальном растягивании — 7,0 мкм. На основании этих данных было высказано предположение, что титин должен быть компактно «упакован» в саркомере (Maruyama, 1986). Таким образом, в случае начального растягивания мышцы сегмент титина, находящийся между концом миозинового фила-мента и Z-линией, является главным фактором, обусловливающим увеличение длины саркомера (Trombitas и др., )993). После того как этот сегмент титина достигнет предела своей длины, рекрутирование дополнительных «завернутых» (скрученных) или каким-то образом прикрепленных к филаменту миозина сегментов титина обусловливает дальнейшее увеличение длины саркомера (Wang и др., 1991). Однако и эта структура имеет свои пределы.
Регулирование растяжимости мышц.В связи с вышесказанным попытаемся ответить на следующие вопросы. Во-первых, что регулирует растяжимость мышц? Во-вторых, можно ли повлиять на фактор(-ы), регулирующий(-е) растяжимость мышц, таким образом, чтобы увеличить гибкость? Первый вопрос изучал Ванг с коллегами (1991). В результате проведенных исследований они установили, что длина и размеры имеют большое значение, если необходимо определить, когда сарко-меры производят напряжение покоя при растягивании и куда исчезает саркомер при нагрузке. Например, мышцы, выражающие более крупные изоформы титина (т.е. структурные варианты), как правило, инициируют напряжение при большей длине саркомера, а также достигают своего предела эластичности. А мышцы, выражающие более длинные изоформы титина, развивают наименьшее напряжение. Ученые также пришли к выводу, что различные мышечные группы выражают различные типы титиновых изоформ и, таким образом, проявляют различные кривые нагрузки-растяжения.
Эти данные говорят о том, что «клетки скелетной мышцы могут контролировать и модулировать туго подвижность и предел эластичности на основании избирательного выражения определенных изоформ титина» (Wang и др., 1991). Любопытно, что наблюдаемые анатомические изменения изоформ титина отмечаются в мышцах из различных участков тела (Akster, Granzier, Focant, 1989; С. Hill, Weber, 1986; Wang, Wright, 1988).
Возникает вопрос, могут ли тренировочные занятия повлиять на определенные изоформы титина? К сожалению, до настоящего времени он остается открытым.
В последнее время изучался и другой весьма важный вопрос: какова взаимосвязь между расщеплением титина и различными нервно-мышечными расстройствами, такими, например, как синдром Шварца-Ям-пеля (Soussi-Yanicostas и др., 1991) и мышечная дистрофия Дюшенна. По мнению Мацумуры и коллег (1989), расщепление титина, «даже вторичное, скорее всего, играет важную роль в патогенезе миофибрилляр-ной дегенерации при мышечной дистрофии Дюшенна». Другим важным
Глава 3- Сократительные компоненты мышцы
 аспектом является влияние на титиновые изоформы различных медикаментов.
аспектом является влияние на титиновые изоформы различных медикаментов.
Весьма важным представляется также выяснить, изменяется ли mo-форма титана вследствие травмы. Если да, то как реагирует организм в случае макротравмы? Могут ли происходить изменения в изоформе вследствие, например, хронически неправильной осанки? Эти и другие вопросы требуют подробного изучения.
Функция титина.Ученые считают, что титин выполняет две важные функции. Во-первых, поскольку эластичные элементы связывают каждый конец толстого филамента с Z-линией, филаменты титина производят напряжение покоя, то есть напряжение, имеющее место при нормальной физиологической длине мышечного волокна и увеличивающееся по мере удлинения расслабленного волокна; кроме того, они производят силу, которая центрирует толстые филаменты в саркомере (Horowits, 1992). Во-вторых, предполагают, что титин играет определенную роль в морфогенезе миофибрилл (Fulton, Isaacs, 1991; Pollack, 1990).
Дата добавления: 2015-05-19; просмотров: 1521;
