Алгоритм решения задачи 6.1.
Исходные данные к типовой задаче (состав минерализованной воды)
| Содержание ионов, мг/л | Свободная СО2, мг/л | ||||||
| Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- | |
| 26,3 | 25,9 | 11,5 | 195,2 | 17,6 |
Решение.
Количество агрессивной углекислоты определяют по графикам, составленным Лаптевым Ф.Ф., в которых используется содержание связанной и свободной углекислоты (см. Приложение). Графиком А пользуются, если
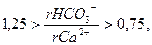 (6.1)
(6.1)
где ri – содержание иона в эквивалентной форме, в других случаях используют график Б.
(расчет ri – см в конце раздела).
1. Определяем величину отношения 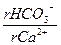 :
:
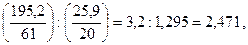
т.к. полученная величина больше 1,25, в дальнейшем используем график Б.
2. Находим суммы эквивалентов Са2+ (а) и НСО3- (в) и удвоенного содержания свободной углекислоты СО2 (с):
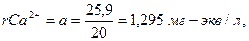 (6.2)
(6.2)
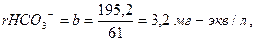 (6.3)
(6.3)
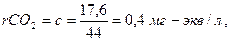 (6.4)
(6.4)
 (6.5)
(6.5)
На графике Б этим суммам отвечает точка, лежащая на кривой, соответствующей эквивалентному содержанию равновесной НСО3- 3,7мг-экв/л. Фактически в воде содержится 3,2 мг-экв/л НСО3-, т.е. равновесноеэквивалентное содержание НСО3- выше имеющегося на 0,5 мг-экв/л (3,7 – 3,2 = 0,5). Это говорит о том, что в системе недостаток НСО3- относительно имеющегося содержания СО2, избыток которого будет придавать воде коррозионную активность. По нижней шкале графика находим, что этот избыток СО2 составляет 11 мг/л.
Зная содержание шести основных ионов вэквивалентной форме, можно, пользуясь классификацией Сулина (табл.6.1), определить тип воды.
Таблица 6.1
Дата добавления: 2015-05-19; просмотров: 2170;
