Основные данные о строении артериальной сети мягкой мозговой оболочки у кролика 5 страница
Однако в клинике закрытие той или иной артерии мозга при отхож-дении ее от виллизиева круга или основных ветвей этих артерий, расположенных в мягкой мозговой оболочке, тромбом или эмболом в большинстве случаев сопровождается размягчением мозгового вещества в бассейне закрытой артерии. Область распадающейся нервной ткани обычно довольно точно совпадает с областью, охватываемой ветвями выключенной артерии. Это обстоятельство указывает на то, что артерии мозга в известных условиях могут оказаться анатомически конечными. Как мы знаем, такого рода клинические наблюдения легли в основу широко распространенной в свое время концепции Конгейма.
Следовательно, существуют условия, при которых непрерывность сосудистой сети в мягкой мозговой оболочке и внутри мозгового вещества нарушается. Коллатеральные сосуды при этом не функционируют, артерии разобщаются одна от другой и приобретают характер конечных.
Вместе с тем отдельные клинические и экспериментальные сообще-
ния говорят о возможном в некоторых случаях закрытии мозговых артерий без последующего расплавления мозговой ткани в зоне выключенного сосуда [Ватте (Watts), 1934; Дэнди (Dendy); Кэмпбелл, 1944; Поппен (Рорреп), 1939; Б. Н. Клосовский, 1947].
Таким образом, вопрос об условиях, в одних случаях обеспечивающих переключение бассейна закрытой артерии на кровоснабжение по коллатералям, в других — приводящих к размягчению нервной ткани, оставался открытым. Для решения его сотрудницей нашей лаборатории Е. Н. Космарской была предпринята экспериментальная работа. Целью этой работы, помимо выяснения физиологических условий, необходимых для осуществления коллатерального кровообращения в мозгу, являлось установление анатомических путей, служащих для перемещения крови в бассейн закрытой артерии. Кроме того, предстояло решить, насколько благоприятные условия для жизнедеятельности основных компонентов нервной ткани создаются при переключении данного участка мозга на кровоснабжение по коллатеральным сосудам.
Для решения поставленных вопросов Е. Н. Космарская предприняла эксперименты на собаках и кошках, у которых производилось выключение передних и средних мозговых артерий одного или обоих полушарий. Особый интерес при этом представляла окклюзия средней мозговой артерии, так как закрытие ее в клинике протекает особенно неблагоприятно и постоянно сопровождается размягчением мозгового вещества в бассейне этого сосуда. По мнению ряда исследователей, плохой прогноз в случаях выключения средней мозговой артерии объясняется недостатком анатомических путей, необходимых для перемещения крови в бассейн, закрытой артерии.
Передние и средние мозговые артерии в опытах Е. Н. Космарской закрывались серебряным клипсом в месте отхождения их от виллизиева круга на основании черепа и часто дополнительно коагулировались электрическим током. При одновременном наблюдении поверхности мозга в области закрытой артерии отмечалось уменьшение или полное прекращение пульсаторных движений и резкое побледнение мозга. Измерение калибра артерий мягкой мозговой оболочки посредством окуляр-микрометра капилляроскопа позволяло констатировать отчетливое сужение сосудов всех диаметров. В наиболее отчетливой форме уменьшение диаметра могло быть прослежено на незначительных по размеру артериях мягкой мозговой оболочки, которые совершенно запустевали. Вместе с тем резко изменялась скорость тока крови по сосудам. Кровь по артериям не шла уже, как это бывает в нормальных условиях, сплошным потоком, было возможно проследить движение эритроцитов, особенно в сосудах среднего и мелкого калибра. В артериолах и венулах кровь двигалась толчками, иногда останавливалась. Отмечался также обратный ток крови в венах. Иначе говоря, венозная кровь с поверхности мозга как бы сливалась вглубь мозгового вещества.
Описанные явления продолжались в течение 1'/2—2 минут. В последующем артерии мягкой мозговой оболочки постепенно возвращались к исходному размеру, характеризовавшему их до опыта. Ток крови в них увеличивался, но, несмотря на заполнение кровью артерий мягкой мозговой оболочки, мозговое вещество бассейна выключенной артерии испытывало кислородное голодание. Это обстоятельство находило свое отражение в том, что цвет мозгового вещества в области закрытой мозговой артерии становился все более синевато-серым. Соответственно с этим изменялся и цвет крови, идущей по сосудам мягкой мозговой оболочки. Цвет крови в артериях все более приближался к цвету ее в
143.
венах, благодаря чему утрачивалось различие обоих родов сосудов, обычно выступающее совершенно отчетливо. Вены расширялись. Венозная гиперемия мозгового вещества постепенно нарастала и в ряде случаев сопровождалась отеком мозгового вещества. Отек мозга был особенно сильно выражен в тех случаях, когда выключение основных мозговых артерий производилось у щенков менее шестимесячного возраста. У молодых взрослых собак венозная гиперемия постепенно уменьшалась, и отека мозга при простом наблюдении не отмечалось.
Анализ данных, полученных Е. Н. Космарекой, позволил ей установить, что закрытие обеих передних мозовых артерий у собак не влечет за собой кровоизлияний и размягчений мозгового вещества в бассейне выключенных сосудов. Результат не менялся от того, насколько быстро одна вслед за другой закрывались передние мозговые артерии. Отсюда можно было заключить, что бассейны, получающие кровоснабжение по передним мозговым артериям у собак, полностью переключаются на коллатеральное снабжение кровью, поступающей к ним из областей средней и задней мозговой артерии.
Значительно более сложные отношения наблюдались в случае закрытия средней мозговой артерии. С одной стороны, было установлено, что выключение средней мозговой артерии у взрослых собак никогда не сопровождается расплавлением нервной ткани в бассейне распределения ветвей закрытой артерии. Более того, оказалось, что у взрослых собак возможно выключение средних мозговых артерий обоих полушарий при условии, если закрытие одной артерии имеет место через некоторый интервал после другой. В таких случаях не было обнаружено ни кровоизлияния, ни некрозов в обоих бассейнах закрытых артерий.
Вместе с тем выключение средней мозговой артерии у щенков до шестимесячного возраста или оканчивалось смертью животного через несколько часов после операции, или имело своим следствием распад нервной ткани в зоне этой артерий. У щенков, погибших в течение ближайших суток после операции закрытия средней мозговой артерии одного из полушарий, на вскрытии всегда отмечалась рыхлая консистенция мозга, а также заклинивание миндалин мозжечка в затылочное отверстие. Таким образом, отек мозгового вещества приводил в этих случаях к ущемлению продолговатого мозга и к смерти животного от остановки дыхательной и сердечной деятельности. При гистологическом изучении мозга размягчений в бассейне закрытой артерии никогда не наблюдалось. Выше уже указывалось, что у части щенков менее шестимесячного возраста, подвергнутых опыту закрытия артерий, после смерти от различных причин или после декапитации были констатированы очаги размягчения мозгового вещества, охватывавшие иногда всю область распределения ветвей закрытой средней мозговой артерии. Как было выяснено, предрасполагающими моментами для размягчения являлось плохое общее состояние щенка до операции и техническая сторона операции. При выполнении операции на щенках требовалось особенно осторожное обращение с мозговой тканью, так как длительное надавливание на нее шпателем или ранение мелкого сосуда может вести к быстрому развитию отека.
Гистологическое изучение мозгов экспериментальных животных дало возможность установить, что во всех случаях закрытия передних или средних мозговых артерий развивается отек мозгового вещества вследствие нарушения нормальной циркуляции крови в мозгу. Начинаясь в бассейне закрытой артерии, отек не ограничивается им, а распространяется и на области распределения ветвей соседних мозговых артерий
того же полушария и даже на мозговое вещество противоположного полушария. Особая сила развития процессов нарушения водного обмена нервной ткани, отмечавшаяся у щенков, заставила предположить, что наблюдавшееся в ряде случаев размягчение в зоне закрытой средней мозговой артерии является следствием сильного отека, пролабирования мозгового вещества и ущемления его в трепанационном отверстии.
Подтверждение высказанному предположению было получено в опытах с выключением передних мозговых артерий. Выше уже указывалось, что закрытие названных артерий в опытах Е. Н. Космарской никогда не сопровождалось размягчением в бассейнах распределения их ветвей. Вместе с тем иногда у щенков после закрытия передних мозговых артерий некротическое расплавление нервной ткани отмечалось в зоне интактной средней мозговой артерии. Объем некроза всегда соответствовал размеру операционного отверстия, постоянно располагавшегося в области снабжения средней мозговой артерии.
Отек мозгового вещества никогда не достигал значительного развития при выключении передних или средних мозговых артерий у взрослых молодых собак. Однако положение вещей менялось, как только выключение артерий производилось на фоне предварительно искусственно пониженного кровяного давления, или понижение давления вызывалось тотчас же после закрытия артерий. В тех случаях, когда мозговая артерия закрывалась в условиях нормального кровяного давления, а затем кровяное давление понижалось, собаки погибали в течение первых суток после операции. Гистологическое исследование всегда указывало на отек мозгового вещества. Если же выключение мозговой артерии у собаки производилось после предварительного снижения общего кровяного давления, к отеку всего мозгового вещества в целом присоединялся некроз его в зоне средней мозговой артерии.
Опыты такого рода позволили заключить, что решающим фактором в исходе операции закрытия мозговых артерий у взрослых молодых собак является величина кровяного давления до и после выключения сосуда. Закрытие артерий на фоне нормального уровня кровяного давления и удержание его на том же уровне после операции обеспечивают переключение бассейна закрытого сосуда на кровоснабжение по коллате-ралям. Выключение мозговых артерий в условиях пониженного кровяного давления или снижение давления после закрытия сосуда ведет к отеку мозгового вещества, тем более сильному, чем значительнее снижается кровяное давление по сравнению с исходным уровнем его до операции. Сильное развитие отека сопровождается пролабированием мозгового вещества, ущемлением его в трепанационном отверстии и некроти-зацией всего участка ущемившейся нервной ткани.
Таким образом, величина кровяного давления в момент закрытия мозговой артерии или после него определяет степень компенсации кровоснабжения в зоне закрытого сосуда.
Вторым фактором, обеспечивающим переключение бассейна закрытого сосуда на коллатеральное кровоснабжение, является анатомическое строение и состояние сосудистой сети мозга. Как было установлено в опытах Е. Н. Космарской, компенсация кровоснабжения бассейна выключенного артериального ствола осуществляется несколькими путями (рис. 85). Первым из них является виллизиев круг. Так, например, при закрытии средней мозговой артерии значительно расширяется передняя мозговая артерия и задняя соединительная артерия соответствующей стороны, которые начинают служить коллатеральными путями для притока крови в область выключенной артерии. При закрытии средних
мозговых артерий обоих полушарий передние мозговые и задние соединительные артерии увеличиваются в диаметре в несколько раз.
Коллатеральное кровоснабжение области закрытой артерии происходит также по сосудам мягкой мозговой оболочки. Артериальные сосуды в зоне смежного кровоснабжения, описанной подробно для мозга собак в соответствующем разделе нашего изложения, заметно увеличиваются в диаметре. Соответственно этому внутримозговая капиллярная сеть в зоне смежного кровоснабжения обнаруживает увеличение просвета составляющих ее капилляров.
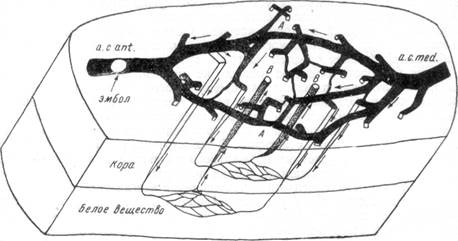
Рис. 85. Схема возможных путей перемещения крови в случае закупорки одной из основных артерий мозга (объяснение в тексте).
Расширение капилляров коры и белого вещества наблюдается тотчас же после закрытия артерии. Капилляры смежной зоны кровоснабжения сохраняют свой более широкий просвет по сравнению с диаметром их в области распределения ветвей соседних мозговых артерий и при последующем отеке, а затем и при постепенно развивающейся атрофии мозгового вещества (рис. 86, г; 87, б; 88, б).
Следовательно, интрацеребральная капиллярная сеть зоны, пограничной между средней и передней мозговой артерией, служит не только для выравнивания давления крови в бассейне закрытого сосуда в момент его выключения, но и для последующего компенсаторного кровоснабжения области закрытой артерии.
Однако, несмотря на существование анатомических путей, для перемещения крови из областей с ненарушенным кровоснабжением в область закрытой артерии коллатеральное кровоснабжение не в состоянии обеспечить нормальную жизнедеятельность всей нервной ткани в бассейне выключенного сосуда.
Мы уже видели, что закрытие мозговой артерии сопровождается резким падением давления и сужением сосудов в области распределения ветвей данной артерии. Но уже через несколько минут сосуды отчетливо расширяются и заполняются кровью. Это обстоятельство указывает на переключение области закрытого сосуда на кровоснабжение по коллатеральным сосудам в мягкой мозговой оболочке, коре и белом веществе внутри мозга.
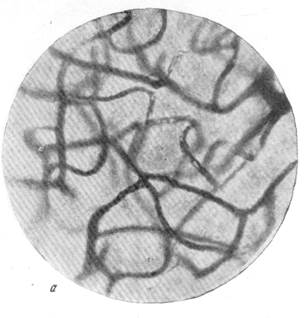
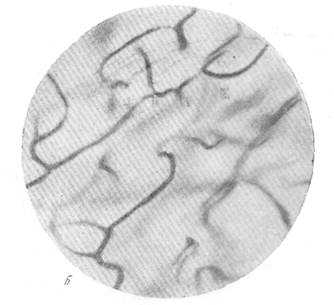
Рис. 86. Расширение капиллярной сети серого вещества в смежной зоне кровоснабжения через 2 часа после закрытия левой средней мозговой артерии. а — капиллярная сеть в бассейне средней мозговой артерии нормальной собаки; б—капиллярная сеть смежной зоны кровоснабжения правого полушария. Импрегнация по методу Б. Н. Клосовского. Увеличение 340.
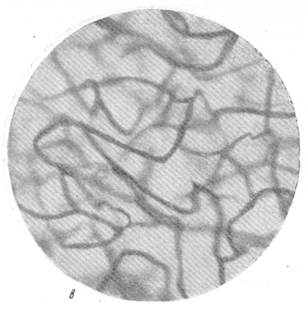
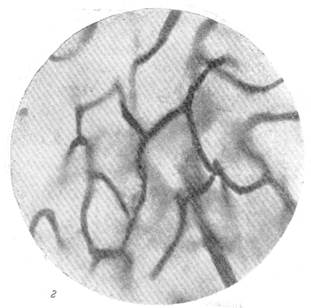
Рис. 86. Расширение капиллярной сети серого вещества в смежной зоне кровоснабжения через 2 часа после закрытия левой средней мозговой артерии.
в — капиллярная сеть в бассейне закрытой левой средней мозговой артерии; г — капиллярная сеть в смежной зоне кровоснабжения левого полушария. Импрегнация по методу Б. Н. Клосовского, Увеличение 340.
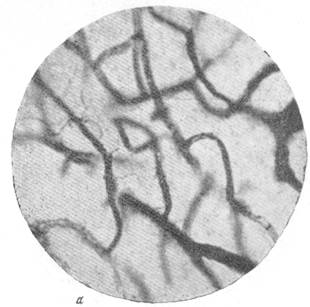
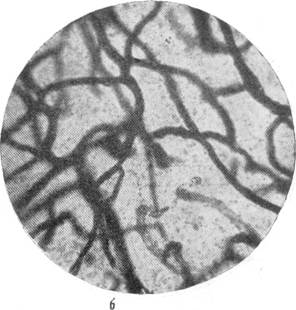
Рис. 87. Капиллярная сеть в коре через 67 дней после закрытия левой средней
мозговой артерии.
а — капиллярная сеть в бассейне передней мозговой артерии; б — капиллярная сеть смежной зоны кровоснабжения.

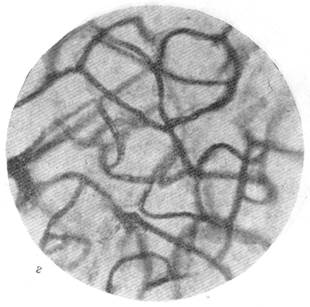
Рис. 87. Капиллярная сеть в коре через 67 дней после закрытия левой средней
мозговой артерии.
в — капиллярная сеть в бассейне закрытой левой средней мозговой артерии; г — капиллярная сеть в бассейне средней мозговой артерии нормальной собаки. Импрегнация серебром по методу Б. Н. Клосовского. Увеличение 340.
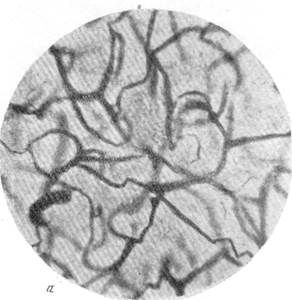
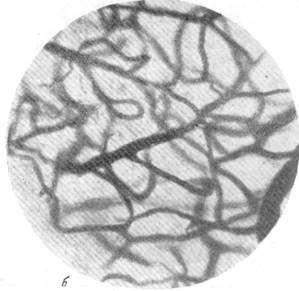
Рис.88. Капиллярная сеть в коре через 23 дня после закрытия обеих передних
мозговых артерий.
а — капиллярная сеть в бассейне закрытой левой передней мозговой артерии; б — капиллярная сеть серого вещества смежной зоны кровоснабжения.
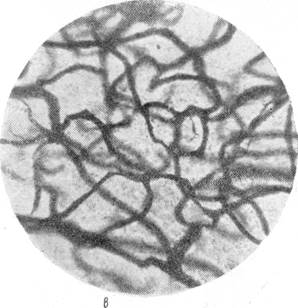
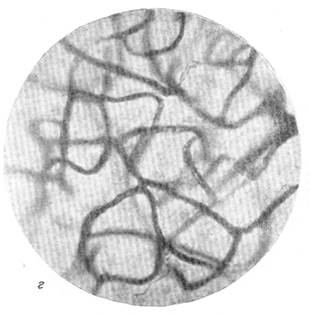
Рис. 88. Капиллярная сеть в коре через 23 дня после закрытия обеих передних мозговых артерий.
в — капиллярная сеть в бассейне средней мозговой артерии; г — капиллярная сеть в
бассейне средней мрзговой артерии нормальной собаки. Импрегнация серебром по методу Б. Н. Клосовского. Увеличение 340.
Однако кровоснабжение по коллатеральным сосудам не вполне достаточно, поскольку начинается венозная гиперемия, указывающая на накопление продуктов обмена веществ в нервной ткани бассейна закрытой артерии. Накопление продуктов обмена веществ неизбежно ведет к отеку мозгового вещества. Степень отека зависит от величины общего кровяного давления в момент закрытия сосуда и после операции, от развития анатомических коллатералей в мягкой мозговой оболочке, от общего состояния животного и от технического совершенства при выполнении операции. После прекращения отека количество крови, поступающей в область выключенной артерии, оказывается недостаточным для нормальной жизнедеятельности нервной ткани. Даже в условиях закрытия мозговых артерий на фоне нормально высокого кровяного давления область мозга, переключенная на коллатеральное кровоснабжение, испытывает хроническую недостаточность питания, выражающуюся в нарастающей атрофии мозгового вещества.
Атрофические явления находят свое выражение в гибели части нервных клеток. При наличии «клеток-теней» имеется большое количество «мест побледнения» и «мест запустения». Клетки располагаются реже, чем в норме. Кислородное голодание и постепенное затихание процессов жизнедеятельности в области закрытого сосуда отражаются и на состоянии астроцитов коры и белого вещества. Капиллярная сеть в зоне выключенной мозговой артерии оказывается сформированной из капилляров с просветом, значительно меньшим по сравнению с нормой (рис. 87, в, г; 88, а, г). Значительное количество капилляров полностью закрывается. Благодаря постепенной атрофии, мозг несколько уменьшается в размерах. Борозды, особенно в областях закрытых артерий, начинают зиять, желудочки мозга увеличиваются. Процессы атрофии с наибольшей силой выступают в бассейне закрытых артерий, но в то же время до известной степени распространяются и на соседние области, получающие кровоснабжение по интактным артериям.
Таким образом, мы видим, что при условии нормального кровяного давления в момент закрытия мозговой артерии и после операции возможно переключение бассейна данной артерии на кровоснабжение по коллатеральным путям. Однако, несмотря на то, что переключение это является достаточным для предотвращения размягчения нервной ткани, оно недостаточно для нормальной жизнедеятельности ее.
Подобно закрытию мозговых артерий перевязка шейных сосудов, питающих мозг собаки кровью, не может считаться индиферентной. Если в первом случае к мозгу поступает нормальное количество крови и лишь в силу выключения отдельного участка мозга происходит перераспределение больших количеств ее, то при перевязке сонных и позвоночных артерий мозг получает меньше крови, чем в норме. Все отделы мозга находятся в условиях пониженного питания.
Перевязка шейных артерий и падение давления в виллизиевом кругу вызывают рефлекторное повышение общего кровяного давления. Повышение последнего служит для образования коллатерального кровообращения и ведет к расширению уже имеющихся коллатеральных сосудов на шее. Степень анатомического развития коллатералей, наряду с величиной общего кровяного давления, определяет размер компенсационного кровоснабжения мозга после выключения шейных артерий.
Опытами Е. Н. Космарской было показано, что кровоснабжение мозга по коллатералям развивается слабо или совсем не имеет места в течение первых десяти минут после закрытия сонных и позвоночных артерий. Благодаря этому чрезвычайно мало устойчивые к недостатку
кислорода нервные клетки частично погибают, а часть сосудистой сети запустевает и закрывается. Но и постепенно развивающиеся коллатеральные сосуды на шее не обеспечивают потребностей ткани мозга в кислороде и питательных веществах, и атрофические процессы в нервной ткани прогрессируют. Хотя сила атрофических процессов находится в прямой зависимости от величины общего кровяного давления, но даже и при наличии высокого уровня его часть нервных клеток гибнет, а довольно значительная часть капилляров закрывается и, возможно, совершенно исчезает. В случаях слабого кровяного давления отмечается не только общая атрофия мозговой ткани, но и некрозы в смежных зонах кровоснабжения.
Принимая во внимание результаты исследований развития и строения артериальной сети мягкой мозговой оболочки, произведенных в нашей лаборатории Е. В. Капустиной, можно полагать, что наибольшая возможность для коллатерального тока крови имеется в мягкой мозговой оболочке. В самом деле, у человека, собаки, кошки и кролика периферические ветви основных мозговых артерий соединяются между собой анастомозами, калибр которых у человека может достигать 300—350 м В смежных зонах кровоснабжения существуют также анастомозы между ветвями одной и той же основной артерии мозга. Имеются анастомозы между ветвями основных мозговых артерий и на территории основного распределения их. В то же время возможности коллатерального перемещения крови в коре и белом веществе мозга ограничиваются капиллярным руслом.
Однако детальное изучение артериальной сети мягкой мозговой оболочки показало, что уже само анатомическое строение ее является препятствием для полного переключения участка нервной ткани на кровоснабжение по коллатералям. Речь при этом безусловно идет о переключении, способном создать нормальные условия жизнедеятельности нервной ткани в районе бассейна закрытого сосуда. Как мы видели, несмотря на отсутствие некротического расплавления, ткань мозга в области выключенного сосуда испытывает хроническую недостаточность питания, что ведет к медленной атрофии ее. Постепенные атрофические процессы в нервной ткани разыгрываются вследствие того, что основная масса наиболее крупных по размеру анастомозов сосредоточивается в зоне смежного кровоснабжения. Анастомозы же между ветвями одной и той же мозговой артерии на территории распределения ее незначительны по размеру и существуют в малом количестве.
Наши наблюдения поверхности мозга через герметически вставленное в череп «окно» показали, что даже в нормальных условиях жизнедеятельности нервной ткани анастомозы на территории распределения ветвей основных мозговых артерий далеко не всегда функционируют. Лишь при повышении общего кровяного давления или при усилении процессов жизнедеятельности того участка мозговой ткани, сосудистая сеть мягкой мозговой оболочки которого изучается через капилляроскоп, отчетливо обнаруживаются анастомозы между ветвями одной и той же артерии.
Понятно, что понижение давления в каком-либо участке мозга при закрытии питающей его артерии будет иметь своим следствием прекращение функции этих анастомозов и разобщение одного участка мозга от другого в смысле кровоснабжения.
Таким образом, кровяное давление в момент закрытия мозговой артерии и после операции имеет решающее значение для ее исхода. Но положение это, доказанное Е. Н. Космарской для мозга собак, может
быть перенесено на человеческий мозг лишь при учете ряда ограничений.
Сравнительное изучение строения артериальной сети собаки и чело-зека показывает, что у человека количество анастомозов между ветвями одной и той же артерии на территории основного размещения каждой мозговой артерии значительно меньше, чем у собаки. Иначе говоря, артериальная сеть мягкой мозговой оболочки человека значительно более диференцирована по сравнению с сетью собаки.
Следовательно, в артериальной сети мягкой мозговой оболочки человека имеется значительно меньшее количество анатомических путей, способных служить в качестве коллатералей при перемещении крови из одного участка мозга в другой. Кроме того, у человека при определении возможностей переключения участка нервной ткани на кровоснабжение по коллатералям необходимо учитывать состояние сосудистой стенки. Последнее имеет огромное значение при всяких колебаниях давления, так как состоянием стенки сосудов определяется способность их к сужение и расширению.
Как уже было указано, перераспределение тока крови, наступающее в мозгу при закрытии одной из основных мозговых артерий, сопровождается резким расширением артерий и капилляров в зоне смежного кровоснабжения. Такого рода расширение возможно только в случае, если сосудистая стенка не поражена никаким патологическим процессом и обладает нормальной подвижностью. При наличии патологически измененной стенки коллатеральные пути окажутся наиболее ранимыми участками сосудистой сети мозга, так как на них падает основная нагрузка при перемещении больших масс крови из одной области мозга в другую.
Глава V РОСТ КАПИЛЛЯРОВ МОЗГА
Одной из наименее разработанных сторон проблемы кровообращения в мозгу является вопрос развития сосудисто-капиллярной сети в эмбриональном периоде и в первые месяцы постнатальной жизни. Имеющиеся в этой области единичные работы страдают общим недостатком — исследователи пытаются установить изменение плотности капиллярной сети в тех или других отделах мозга с увеличением возраста и при патологических состояниях простым подсчетом количества капилляров, приходящихся на единицу объема мозгового вещества.
Пфайфер и Линдгрин, исследовавшие насыщенность капиллярами головного мозга новорожденных и стариков, пришли к совершенно противоположным выводам. Пфайфер считал, что количество капилляров на единицу объема у новорожденных и стариков одно и то же, Линдгрии же пришел к выводу, что капиллярный индекс у стариков значительно ниже, чем у молодых. Два других автора, работая над изучением развития капиллярной сети у животных, также высказали противоположные мнения о количестве капилляров. Креги (Craigie) установил, что у новорожденного крысенка сеть менее густа, чем у взрослой крысы. Корнуэль (1927) утверждал, что наибольшая густота капиллярной сети у крыс наблюдается перед рождением.
С другой стороны, Тзанг (Tsang, 1936), поставивший своей целью проследить изменения состояния капиллярной сети при вторичном перерождении, следующие после удаления затылочной или теменно-височ-ных долей у крысы, отмечал увеличение числа капилляров в соответствующих наружном и внутреннем коленчатом теле по сравнению с числом их в тех же образованиях противоположной стороны. Произведенные подсчеты числа капилляров на единицу площади послужили для Тзанга поводом к заключению о размножении капилляров при вторичной дегенерации, сделанному, как мы видим, на основании косвенных показаний при отсутствии данных о непосредственном росте капилляров. Такие показания ставят под сомнение утверждение этого исследователя, что отмеченное им увеличение числа капилляров на единицу площади является результатом их размножения.
Действительно, наблюдавшееся увеличение могло быть всего лишь следствием более плотного расположения того же самого количества капиллярных петель на уменьшившемся пространстве частично подвергшегося клеточной дегенерации коленчатого тела.
С большой осторожностью приходится также относиться к описанию увеличения числа капилляров в некоторых долях мозга при про-
грессивном параличе. Так же как в предыдущем случае, здесь атрофия мозгового вещества и консолидация одного и того же количества капилляров на уменьшившемся пространстве могут дать повод для ложного заключения об увеличении (размножении) капилляров в этих условиях. Изучая отек, набухание и сморщивание мозга, мы могли убедиться в значительных изменениях плотности одной и той же капиллярной сети без какого-либо уменьшения или увеличения числа составляющих ее капилляров лишь в силу изменения состояния самого мозгового вещества.
Таким образом, надо думать, что критерий подсчета увеличения или уменьшения числа капилляров в единице объема мозга должен сохра-нять свою силу в тех случаях, когда сравнению подвергается густота капиллярной сети в мозгах, находящихся в одном и том же состоянии, с выявлением капилляров одной и той же методикой.
Подлинное же представление об изменениях капиллярной сети может быть получено при учете не только происходящих в ней процессов размножения капилляров, но и при сопоставлении последних с одновременно идущими процессами гибели части существующего уже капиллярного русла.
Вместе с тем убеждение в подлинном размножении капилляров может быть достигнуто лишь на основании непосредственного наблюдения растущих капилляров, при прослеживании различных фаз, которые проходит капилляр в период своего роста.
Многое в вопросе о кровоснабжении мозга может и должно быть разрешено путем установления способа роста мозгового капилляра. Определение способа его роста, а также условий, благоприятствующих или затрудняющих его развитие, может дать объяснение организации сосудисто-капиллярной сети при различного рода воспалительных и дегенеративных заболеваниях центральной нервной системы, например, при травме, опухолях мозга, родовой травме и т. д.
Изучение литературных источников, однако, показывает, что д о настоящего времени совершенно не существовало представлений о ростекапилляр, а вмозгу втечение нормального эмбриогенеза, а также в ходе нормального развития человека и животных в постнаталь-ной жизни. Имеющиеся литературные крайне ограниченные данные касаются роста сосудов лишь при некоторых патологических состояниях мозговой ткани.
Наиболее частым является описание сосудистой пролиферации при организации некротических расплавлений ткани мозга, возникающих при различного рода нарушениях кровообращения.
Дата добавления: 2015-05-16; просмотров: 1184;
