ВОДОРОДНАЯ СВЯЗЬ
Атомы водорода, которые ковалентно связаны с атомом элемента, имеющего .высокую электроотрицательность (чаще всего F, О, М, а также Сl, S и С), несут на себе относительно высокий эффективный заряд. Вследствие этого такие атомы водорода могут электростатически взаимодействовать с атомами указанных элементов. Так, атом Нd+ одной молекулы воды ориентируется и соответственно взаимодействует (что показано тремя точками) с атомом О другой молекулы воды:
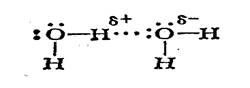
В твердой воде (лед) каждый атом О тетраэдрически окружен четырьмя атомами Н (два из них связаны ковалентно, два других — электростатически); получается соответствующая кристаллическая решетка льда. В жидкой воде практически отсутствуют свободные молекулы Н2О, которые за счет электростатического взаимодействия указанного типа объединяются в агрегаты (Н2О)n, при комнатной температуре среднее значение nравно 4. Этим объясняется меньшая летучесть воды (т. кип. +100<>С), чем у ее аналогов, в частности, у сероводорода Н2S (т. кип, -60 °С).
Связи, образуемые атомом Н, находящимся между двумя атомами электроотрицательных элементов, называются водородными.
Энергия ковалентной составляющей водородной связи А—Н имеет значение порядка 102 кДж/моль (F—Н 565, О—Н 459, Ы—Н 386 кДж/моль), а электростатическая составляющая — порядка 10 кДж/моль (т. е. она намного менее прочная). Однако силы Ван-дер-Ваальса значительно слабее (»1 кДж/моль), чем электростатическая составляющая водородной связи.
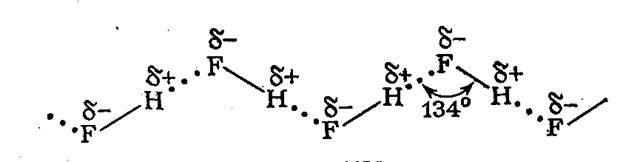
Пример: агрегации молекул за счет водородных связей образование зигзагообразных цепей в жидком фтороводороде НF:
Электростатическая модель образования водородных связей верна только в первом приближение, поскольку энергетически дополнительное связывание атома водорода должно иметь химическую природу. Метод валентных связей не может объяснить образование дополнительной связи атома Н, так как атом водорода одновалентен. Метод молекулярных орбиталей в его многоцентровом варианте дает следующее объяснение образования во-дородной связи. При сближении атома Н, ковалентно связанного с атомом электроотрицательного элемента А—Н , е другим атомом также электроотрицательного элемента Вd- возникает трехцентовая связывающая молекулярная орбиталь, пребывание в которой электронной пары атома Вd- более выгодно, чем на атомной орбитали этого же атома.
Дата добавления: 2015-05-13; просмотров: 1256;
