Скорость химических реакций.
Под скоростью химической реакции понимается изменение концентрации реагирующих веществ в единицу времени.
Чтобы вычислить u реакции нужно определить, насколько изменилась концентрация одного из реагирующих веществ в единицу времени (рис. 1).
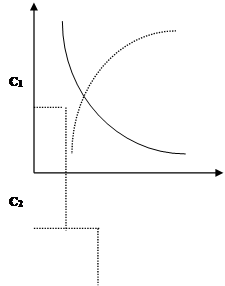 |
|
|
Dt=t2-t1, -DC=C2-C1 Þ u= -DC/Dt
Знак минус говорит о том, что с уменьшением С скорость тоже уменьшается. Если u рассчитывается по одному из продуктов реакции, то u=DC/Dt . Несмотря на знак минус в уравнении u считается положительной величиной.
Более применимое вычисление скорости хим. реакции вытекает из закона действия масс.
Согласно этому закону u~ концентрации реагирующих веществ в данный момент времени. Для реакции А®В, u может быть выражена следующим кинетически уравнением: u=КСА, где СА - концентрация вещества А в данный момент времени, К - коэффициент пропорциональности - константа u химических реакций.
При взаимодействии 2х и более веществ mA + nB ®pC + gD, математическое выражение скорости будет: u=KCAmCBn. т.е. u химических реакций прямо пропорциональна произведению реагирующих веществ, стехиометрические коэффициенты входят в уравнения в виде степени при соответствующей концентрации.
Константа u химической реакции не изменяется при изменении концентраций реагирующих веществ. Иногда К называют удельной скоростью реакции, т.е. при СА = СВ = 1, К = u.
Константа скорости зависит от природы реагирующих веществ, t0, присутствия примесей (в том числе катализаторов), от среды в которой протекает реакция.
Чем больше константа скорости, тем быстрее идет реакция.
3. Влияние t0 на скорость химической реакции.
Опыт показывает, что с повышением t0 скорость химических реакций возрастает. В уравнении химической кинетике u=КCАСВ влияние t0 включает в себя К. С увеличением t0 возрастает К Þ и возрастает u.
Если через Кt - конст. при t0 = t0, а Kt+10 при t0=t0+10 его, то отношение величины первой называется температурным коэффициентом скорости реакции (g),
g= Kt+10/ Kt.
Согласно эмпирическому правилу Вант-Гоффа g колеблется от 2 до 4, т.е. повышая t0 на 100 u возрастает в два- четыре раза.
Пример если g = 2, t0 + 1000, то скорость реакции увеличится в 1024 раза, т.е.
Kt+100/ Kt=g10=210=1024.
увеличение температуры в арифметической прогрессии, влечет за собой увеличение скорости реакции, в геометрической.
Хотя из правила Вант-Гоффа коэффициент g должен быть постоянным для каждой химической реакции, это справедливо лишь на очень узком интервале температур. При значительных перепадах температуры g значительно уменьшается при увеличении температуры (рис. 2).
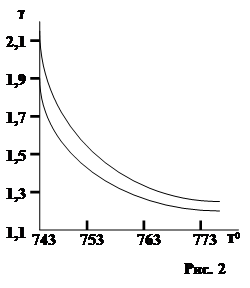 |
Точная зависимость К скорости реакции от t0 была найдена Аррениусом. Уравнение Аррениуса имеет вид:
lnK=B - A/T
где К - константа u реакции; А и В - постоянные характерные для данной реакции; Т - температура.
как видно из уравнения lnК обратно пропорционален Т. Коэффициенты А и В находят графически (рис. 3).
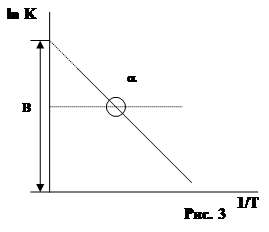 |
Дата добавления: 2015-05-13; просмотров: 1086;
