МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
Металлы и сплавы металлов кристаллизуются в форме металлических решеток. Узлы в металлической решетке заняты положительными ионами металлов (атомными остовами металлов). Все металлы, за редкими исключениями, кристаллизуются в одном из трех типов решеток. При кубической плотневшей упаковке атомных остовов формируется гранецентрированная решетка, при гексагональной плотневшей упаковке — гексагональная решетка. Кристаллы щелочных металлов, бария и некоторых переходных металлов образуют объемно центрированную кубическую решетку. Названия решеток соответствуют упаковке атомных остовов в вершинах и серединах граней элементарного куба, в виде гексагональной призмы и в вершинах и геометрическом центре элементарного куба.
Заполнение гранецентрированной кубической и гексагональной решеток атомными остовами является максимально возможным при данных геометрических размерах атомных остовов металлов поэтому такие виды упаковок атомов называются плотневшими. Плотневшим упаковкам атомов соответствует и максимальное координационное число решетки, т. е. число ближайших соседей, окружающих данный атомный остов в пространстве. Для кубической и гексагональной плотневших упаковок координационное число равно 12 в объемно центрированной кубической решетке координационное число равно 8.
Валентные электроны, отделившиеся от атомов металлов и оставившие в узлах решетки соответствующие атомные остовы (катионы), более или менее свободно перемещаются в пространстве между катионами и обусловливают металлическую электрическую проводимость металлов. По аналогии с молекулами газообразного вещества, совершающими хаотическое движение, подвижные электроны рассматривают как электронный газ в металле.
Устойчивость металлической решетки обеспечивается наличием электростатического притяжения между положительно заряженными атомными остовами и отрицательно заряженными подвижными электронами. Связывающие кулоновские силы действуют на все соседние атомные остовы равномерно и поэтому они менее прочные, чем силы направленного химического связывания в атомных кристаллических решетках. Вследствие этого большинство металлических простых веществ, в отличие от алмазоподобных веществ, имеют относительно низкие температуры плавления, например:
Сs Nа Sn РЬ А1 Ва Аg Сu Fе
т. пл., °С 29 98 232 328 660 727 962 985 1539
(Важнейшие исключения: Мо 2620, Rе 3190, W 3387 °С).
Подобно атомам в атомных решетках и ионам в ионных решетках, катионы в металлических решетках, не обладающие поступательным движением, постоянно совершают колебания вокруг положения узлов решетки. Амплитуда этих колебаний при нагревании возрастает, и при достижении температуры плавления металла решетка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах и с уменьшением расстояния между атомными остовами в решетке — параметра решетки а.
кальций плавится при значительно более высокой температуре, чем калий, в основном по причине удвоенного числа валентных электронов (параметры их решетки почти одинаковы).
От упаковки кристаллических решеток зависит пластическая деформируемость (ковкость) металлов. Она тем выше, чем больше в металлической решетке плотневших шаровых слоев (плоскостей трансляции, т. е. плоскостей параллельного переноса слоев) и чем меньше пустот, тормозящих скольжение слоев. Наименьшая ковкость у металлов с гексагональной решеткой, промежуточная — с объемно центрированной кубической решеткой и наибольшая — с гранецентрированной кубической решеткой.
П р и м е р. При нагревании железа до 911°С низкотемпературная объемно центрированная кубическая решетка (так называемое a-железо) переходит в гранецентрированную кубическую решетку (так называемое g-железо); по этой причине раскаленное железо значительно легче поддается ковке.
При затвердевании металлических расплавов происходит массовая кристаллизация и возникает одновременно множество мелких кристалликов, они называются кристаллитами. Рост кристаллита протекает в окружении подобных мелких кристаллов, при этом исключается значительное увеличение размеров кристаллитов и поэтому они не видны визуально на изломе металла и образец металла кажется монолитным.
Смеси двух или более индивидуальных металлов называются сплавами. В сплавах могут присутствовать в небольших количествах и некоторые неметаллы. Распространенным методом получения сплавов является совместное нагревание их составных частей до полного расплавления смеси. Однако есть металлы, которые не сплавляются друг с другом в любых отношениях.
Металлические сплавы можно классифицировать так: твердые растворы внедрения; твердые растворы замещения; смеси индивидуальных кристаллов металлов; смеси кристаллов интерметаллических соединений.
В сплавах, представляющих собой твердые растворы внедрениярис. 26а, часть межузельных полостей металлической кристаллической решетки занята атомами другого элемента (например, углерода). Такие примеси часто упрочняют сплав, например, чугун, сталь — железо, содержащее примесные атомы углерода, значительно тверже, чем чистое железо.
В сплавах — твердых растворах замещения рис. 26бчасть атомов основного вещества заменена на атомы примесного элемента. Сплавы, состоящие из смеси индивидуальных кристаллических компонентов, образуются при соблюдении строго определенного соотношения; такие сплавы называются также эвтектическими смесями. Эвтектической смесью является широко известный0 оловянный припой — третник (64% Sn и 36 % РЬ) c т. пл. 181 °С.
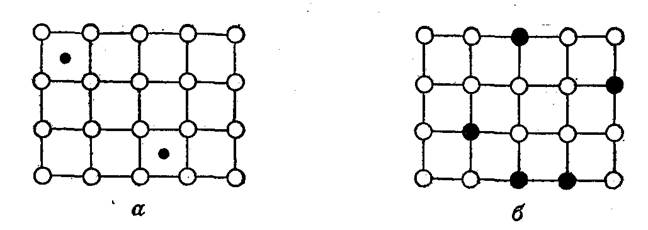
Рис. Структура твердых растворов внедрения (а) и замещения (б), со-держащих атомы двух металлических элементов
Дата добавления: 2015-05-13; просмотров: 1308;
