ИОННАЯ СВЯЗЬ
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента.
Чисто - ионная связь есть предельный случай ковалентной связи.
На практике полный переход электрона от одного атома к другому атому-партнеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую (но не нулевую) электроотрицательность, и любая химическая связь будет в некоторой степени ковалентной.
Если степень ковалентности связи достаточно высока, то такая химическая связь является полярной ковалентной связью с той или иной степенью ионности. Если же степень ковалентвостн связи мала по сравнению со степенью ее ионности, то такая связь считается ионной.
Ионная связь возможна только между атомами электроположительныхи электроотрицательных элементов,находящимися в состояния разноименно заряженных ионов.
Процесс образования ионной связи позволяет объяснить электростатическая модель, т. е. рассмотрение химического взаимодействия между отрицательно и положительно заряженными ионами.
Ионы — это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или приема электронов.
При отдаче или приеме электронов молекулами образуются молекулярные, или многоатомные ионы, например, NО2- — нитрит-ион.
Одноатомные положительные ионы, или одноатомные катионы, и одно атомные отрицательные ионы, или одноатомные анионы, возникают при химической реакции между нейтральными атомами путем взаимопередачи электронов. При этом атом электроположительного элемента, обладающий небольшим числом внешних электронов (одним — двумя, реже тремя—четырьмя), переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов (отдача электронов). Наоборот, атом электроотрицательного элемента, имеющий большое число внешних электронов (от трех до семи), переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов (прием чужих электронов). Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы — неметаллами.
При передаче электронов атомы металлического и неметаллического элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает вокруг своего остова внешнюю оболочку последующего благородного газа (электронный октет),тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую октетную конфигурацию предыдущего благородного газа.
П р и м е р: Атом натрия Nа (электронная конфигурация 1s22s22р63s') имеет одинвнешний электрон (электрон третьего энергетического уровня), а атом хлора С1 (электронная конфигурация 1s22s22р63s23р5) — семь внешних электронов. При переходе от атома натрия Na внешнего 3s-электрона к атому С1 электронная оболочка атома хлора становится внешней электронной оболочкой атома аргона (Зs23р8), а электронная оболочка натрия — внешней оболочкой атома неона (2s22p6), так как на третьем энергетическом уровне натрия не остается ни одного электрона (рис. 24). При этом атом натрия теряет один отрицательный заряд и становится катионом N3+, а атом хлора приобретает этот заряд и становится анионом С1-.
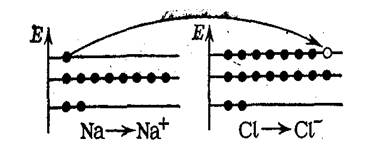
Рис. Переход электрона от атома Ка к атому Cl
Оценка зарядов на атомах натрия и хлора в состоянии ионов следует из сравнения числа протонов в их ядрах и общего числа электронов на их оболочках.
Nа —> Nа+ С1 —> Сl-
Ядро 11р+ 11р+ 17р+ 17р+
Оболочка 11е- 10е- 17е- 18е-
В рамках орбитальной модели атома образование ионов Na+ и С1- объясняется так:
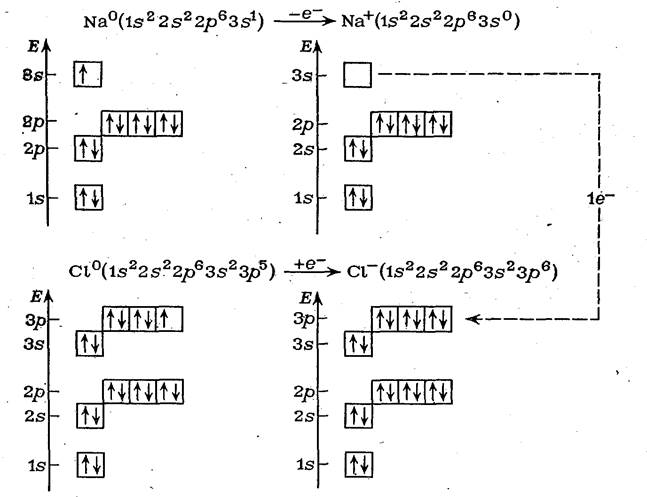
Переход Зs-электрона атома натрия на Зp-подуровень хлора показан пунктирной стрелкой справа. Третий энергетический уровень имеет еще пять Зd-АО, но так как 3d-подуровень начинает заполняться только у атомов элементов четвертого периода, он здесь не показан ион С1- находится в промежуточном устойчивом состоянии благородного газа.
Для простоты вместо эффективных зарядов обычно указывают целочисленные заряды ионов (Nа+)(С1-), имея в виду, что именно такие ионы образуются при электролитической диссоциации ионного соединения NаС1 в водном растворе или в расплаве: NаС1 = Nа+ + С1-.
Для того, чтобы решить, является ли данная связь преимущественно ковалентной или преимущественно ионной (и соответствующим способом интерпретировать свойства соединений), можно прибегнуть к оценке по методу Полинга. Химическая связь с 50 %-ой ионностью отвечает разности Dc= 1,7; при Dc > 1,7 связь будет по преимуществу ионная, например, как для NаС1 (Dc= 2,1), например:
| CsCl | BaCl2 | MgCl2 | AlCl3 | SnCl2 | BiCl3 | |
| Dc | 2,3 | 2,1 | 1,8 | 1,5 | 1,2 | 1,1 |
Очевидно, что СзС1, ВаС12 и МgС12 — ионные соединения, остальные хлориды (А1С13, SпСl2 и ВiС1з) — ковалентные.
Чтобы изобразить образование ионов в химической реакции между нейтральными атомами, уравнение химической реакции записывают с помощью электронных формул:
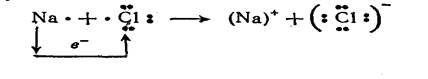
При этом следует использовать правило равенства чисел электронов, переданных в реакции: число отданных электронов должно быть равно числу принятых электронов.
Дата добавления: 2015-05-13; просмотров: 1360;
