Закон действующих масс. На основе кинетических представлений о ходе химических реакций был получен закон действующих масс, который гласит:
На основе кинетических представлений о ходе химических реакций был получен закон действующих масс, который гласит:
«В однородной среде при постоянной температуре скорость реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам реакции»
Для протекания реакции необходимо, чтобы произошло столкновение между молекулами. Поэтому скорость реакции 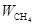 будет тем выше, чем больше концентрация реагирующих веществ. Для реакции окисления метана кислородом закон действующих масс может быть записан в виде
будет тем выше, чем больше концентрация реагирующих веществ. Для реакции окисления метана кислородом закон действующих масс может быть записан в виде
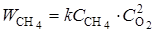 , (3.2)
, (3.2)
где k – константа скорости химического реагирования, зависящая от температуры согласно закону Аррениуса:
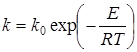 , (3.3)
, (3.3)
здесь k0 – предэкспоненциальный множитель;
R = 8314 – универсальная газовая постоянная, Дж/(моль×К);
Е - энергия активации, необходимая для разрушения внутримолекулярных связей, Дж/моль.
Энергия активации Е определяет скорость реакции: чем она меньше, тем быстрее протекает реакция. Для большинства горючих газов Е составляет
Е = 80…120 кДж/моль.
Не все столкновения молекул приводят к реагированию. Упрощенно можно считать, что Е – необходимый уровень энергии сталкивающихся молекул, k0 - это общее число столкновений, k – число прореагировавших молекул.
С повышением температуры резко растет число сталкивающихся молекул, обладающих достаточным уровнем энергии, что увеличивает скорость реакции.
Дата добавления: 2015-05-13; просмотров: 1035;
