Закон действующих масс. Константы равновесия
Химические реакции не протекают до полного исчезновения исходных веществ и останавливаются при достижении определенного состояния химического равновесия. С практической точки зрения важно знать, в какую сторону сдвинуто равновесие, какой будет состав продуктов реакции и т. д. Для решения подобных задач необходимо научится характеризовать равновесие и найти параметры, от которых оно зависит. Общие соотношения (16.25), (16.32), (16.77), вытекающие из второго закона термодинамики, дают возможность установления условий химического равновесия. Пусть имеется гомогенная газовая химическая реакция
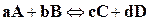 ,
,
где a, b, c, d – числа молей (стехиометрические коэффициенты) соответствующих веществ A, B, C, D.
Обозначим через 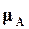 ,
, 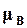 ,
, 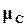 ,
, 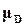 химические потенциалы этих веществ, при равновесии. Условия равновесия для этой реакции между газами по (16.77) выполняются тогда, когда
химические потенциалы этих веществ, при равновесии. Условия равновесия для этой реакции между газами по (16.77) выполняются тогда, когда
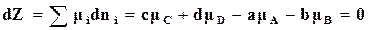 . (17.6)
. (17.6)
Если к исходным веществам и продуктам реакции применимы законы идеальных газов, то значение химического потенциала компонентов можно взять по (16.78). Тогда
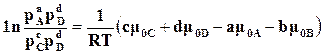 . (17.7)
. (17.7)
Так как первая часть уравнения (17.7)постоянна при определенной температуре, то и левая часть также должна быть постоянна.
Если обозначить 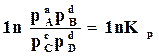 , то
, то 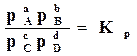 . (17.8)
. (17.8)
Таким образом, парциальные давления газов при равновесии связаны между собой определенным соотношением. Это соотношение и является выражением закона действующих масс, по которому отношение произведений парциальных давлений исходных веществ и продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам в уравнении реакции, при постоянной температуре, есть величина постоянная. Оно называется константой равновесия химической реакции по парциальным давлениям – 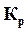 .
.
Константы равновесия можно вызвать и через концентрации. Подставив уравнение (17.5) в (17.8), получим
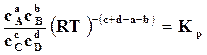 или
или 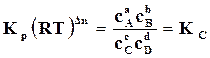 , (17.9)
, (17.9)
где 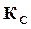 – константа равновесия химической реакции по концентрациям.
– константа равновесия химической реакции по концентрациям.
Численно 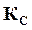 совпадает с
совпадает с 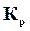 только для тех газообразных реакций, в которых не происходит изменение числа молей
только для тех газообразных реакций, в которых не происходит изменение числа молей
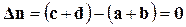 .
.
При определенных внешних условиях скорость химической реакции определяется концентрациями реагирующих веществ. Пусть имеется реакция
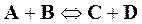 ,
,
в которой скорость прямой реакции, т. е. реакция превращения веществА иВ в вещества C и D равна 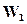 , а скорость обратной реакции
, а скорость обратной реакции 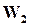 . На основании закона действующих масс можно написать:
. На основании закона действующих масс можно написать:
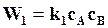 ;
; 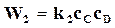 ,
,
где 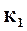 ,
, 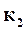 ─ константа скорости прямой и обратной реакции;
─ константа скорости прямой и обратной реакции;
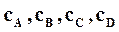 – концентрации веществ в данный момент.
– концентрации веществ в данный момент.
Если реакция выражается более сложным уравнением, в которое входит равное количество молей веществ, например,
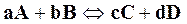 ,
,
то скорости реакций, аналогично предыдущему, будут выражаться следующими формулами
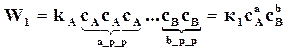 ,
, 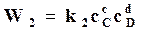 .
.
На основании этого для реакции водяного газа по уравнению (17.1) можно написать
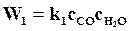 ,
, 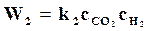 .
.
При протекании реакции слева направо скорость прямой реакции уменьшается вследствие уменьшения концентраций исходных веществ, а скорость обратной реакции соответственно увеличивается. Вполне естественно, что наступает момент, когда скорости прямой обратной реакции сделаются равными
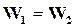 . (17.10)
. (17.10)
На основании вышесказанного можно заключить, что в реакции наступило химическое равновесие и количество получаемых в единицу времени конечных веществ равно количеству веществ, разлагающихся обратно в вещества А и В; таким образом, при наступлении равновесия обе реакции продолжают идти с одинаковой скоростью, т. е. химическое равновесие является динамическим.
Подставляя в равенство (17.10) значения скоростей реакций, находим
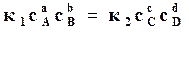 ,
,
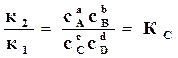 . (17.11)
. (17.11)
Константы скорости 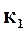 и
и 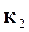 представляют собой коэффициенты пропорциональности, учитывающие полноту столкновения молекул и их взаимную ориентацию в момент соударения.
представляют собой коэффициенты пропорциональности, учитывающие полноту столкновения молекул и их взаимную ориентацию в момент соударения.
В гетерогенных реакциях, т. е. в реакциях, где, кроме газов, участвуют конденсированные вещества (твердые тела и жидкости) в общее давление смеси, кроме парциальных давлений, реагирующих газообразных веществ, входят пары этих конденсированных веществ. Например, для реакции горения твердого углерода
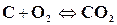 давление газовой смеси равно
давление газовой смеси равно 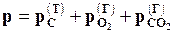 .
.
Но давление 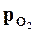 и
и 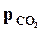 меняются по ходу реакции, а
меняются по ходу реакции, а 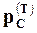 остается постоянным, так как реакция происходит при постоянной температуре.
остается постоянным, так как реакция происходит при постоянной температуре.
На этом основании при вычислении константы равновесия для гетерогенных реакций давления паров твердых и жидких тел как величины постоянные относят к величине константы равновесия, и, следовательно, для реакции горения углерода константа равновесия выражается уравнением
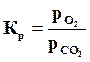 .
.
Закон действующих масс [уравнения (17.8), (17.9)], полученный для смеси идеальных газов, применим и к процессам диссоциации и к рекомбинации молекул, которые имеют место в камерах сгорания и соплах ракетных двигателей.
Дата добавления: 2015-04-03; просмотров: 1716;
