Влияние температуры реакции на химическое равновесие
Положение химического равновесия зависит от температуры реакции. Следовательно, температура реакции влияет на все величины, связанные с химическим равновесием. Выведем уравнение, определяющее зависимость константы равновесия от температуры. Для этого используем уравнение максимальной работы (16.48) и (17.14)
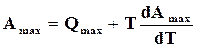 , (а)
, (а)
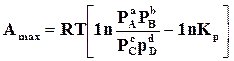 . (б)
. (б)
Определяем из уравнения (б) 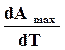 , принимая произведение начальных парциальных давлений величиной постоянной
, принимая произведение начальных парциальных давлений величиной постоянной
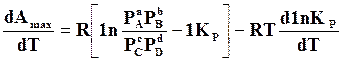 .
.
Полученное значение подставляем в уравнение (а)
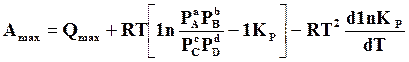 , или
, или
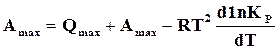 .
.
Следовательно,
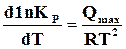 . (17.17)
. (17.17)
Это уравнение одинаково и для изохорной, и для изобарной реакции.
При переходе к десятичным логарифмам, пологая, что 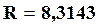 кДж/(моль∙град),окончательно получаем
кДж/(моль∙град),окончательно получаем
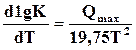 . (17.18)
. (17.18)
Полученная зависимость позволяет обнаружить влияние температуры реакции на химическое равновесие. Для экзотермических реакций тепловой эффект положителен, следовательно, левая часть полученного уравнения также положительна, т. е. 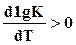 и
и 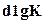 , и
, и 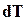 имеют одинаковые знаки. Если температура реакции повышается, то увеличивается константа равновесия. Отсюда следует, что к моменту равновесия давления исходных веществ делаются больше, и реакция походит менее полно: равновесие сдвигается влево и увеличивается степень диссоциации. Для более полного протекания изотермической реакции необходимы более низкие температуры.
имеют одинаковые знаки. Если температура реакции повышается, то увеличивается константа равновесия. Отсюда следует, что к моменту равновесия давления исходных веществ делаются больше, и реакция походит менее полно: равновесие сдвигается влево и увеличивается степень диссоциации. Для более полного протекания изотермической реакции необходимы более низкие температуры.
Аналогичные рассуждения для эндотермических реакций приводят к выводу, что полнота такой реакции увеличивается при повышении температуры, а степень диссоциации уменьшается.
Согласно принципу Ле-Шателье изменение внешних условий, определяющих равновесие химической системы, приводит к химической реакции прямой или обратной, развитие которой уменьшает влияние произведенного воздействия.
Если система получила теплоту извне, то в ходе реакции, согласно этому принципу теплота должна поглощаться. Если изменение внешних условий связано с увеличением давления (уменьшение объема), то в ходе реакции объем системы уменьшается. При наличии внешних воздействий нарушается равенство скоростей прямой и обратной реакций, условия характеризующего состояние равновесия в системе. Новое состояние равновесия устанавливается в зависимости от развития прямой или обратной реакций.
Дата добавления: 2015-04-03; просмотров: 1722;
