Связь между константой равновесия и степенью диссоциации
Зависимость между константой равновесия и степенью диссоциации имеет разную форму для разных реакций. Рассмотрим основные виды реакций, встречающихся в процессах горения.
1) Реакции горения, происходящие с уменьшением числа молей. К этим реакциям относятся однотипные реакции горения водорода и окиси углерода
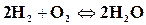 ,
, 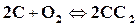 .
.
Рассмотрим реакцию горения водорода. Пусть при определенной температуре реакции, для которой известна величина константы равновесия 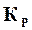 , к моменту равновесия не прореагировала α-я часть моля. В продуктах горения вместо 2 моль водяного пара будет только 2 (1─α) моль, но вместо 2α мольпара останутся в смеси не прореагировавшие водород и кислород в количестве: водорода 2α моль, а кислорода α моль. Состав продуктов сгорания к моменту равновесия будет следующий
, к моменту равновесия не прореагировала α-я часть моля. В продуктах горения вместо 2 моль водяного пара будет только 2 (1─α) моль, но вместо 2α мольпара останутся в смеси не прореагировавшие водород и кислород в количестве: водорода 2α моль, а кислорода α моль. Состав продуктов сгорания к моменту равновесия будет следующий
водяного пара 2(1─α) моль,
водорода . . . . . .2α моль,
кислорода . . . . . α моль.
Всего (2+α) моль.
Используя формулы для газовых смесей, находим парциальные давления компонентов в виде:
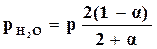 ;
; 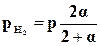 ;
; 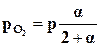 .
.
Зная парциальные давления, по формуле (17.8) находим константу равновесия
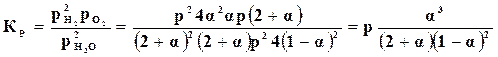 . (17.12)
. (17.12)
Это уравнение дает зависимость между константой равновесия и степенью диссоциации. Константа равновесия для определенной температуры имеет вполне определенное значение. Степень диссоциации определяется давлением, при котором происходит диссоциация. Для вычисления этого влияния в паровой части уравнения (17.12) числитель и знаменатель разделим на 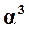
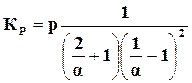 .
.
При 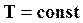 и повышении давления степень диссоциации уменьшается, т. е. полнота горения увеличивается, увеличивается количество получаемого водяного пара. Количество водорода и кислорода уменьшается; в этом случае говорят, что равновесие сдвигается вправо.
и повышении давления степень диссоциации уменьшается, т. е. полнота горения увеличивается, увеличивается количество получаемого водяного пара. Количество водорода и кислорода уменьшается; в этом случае говорят, что равновесие сдвигается вправо.
2) Реакции, происходящие без изменения числа молей газообразных участков реакции. К таким реакциям можно отнести реакцию водяного газа
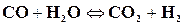 .
.
Константа равновесия этой реакции определяется из выражения
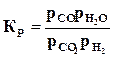 .
.
Рассматривая эту реакцию, находим следующее. Если степень диссоциации равна 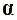 , то к моменту равновесия в смеси будет не по одному молю
, то к моменту равновесия в смеси будет не по одному молю 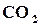 и
и 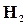 , а только по (1─α) моль, но зато остается по α моль
, а только по (1─α) моль, но зато остается по α моль 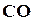 и
и 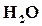 , которые не могли прореагировать вследствие диссоциации. Следовательно, состав смеси и парциальные давления компонентов к моменту равновесия будут следующие:
, которые не могли прореагировать вследствие диссоциации. Следовательно, состав смеси и парциальные давления компонентов к моменту равновесия будут следующие:
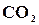 (1─α) моль,
(1─α) моль,
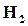 ……………..(1─α) моль,
……………..(1─α) моль,
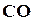 ………………...α моль,
………………...α моль,
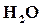 ……………….α моль.
……………….α моль.
_________________________
Всего……………….2 моль
Находим константу равновесия
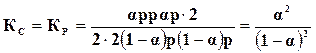 . (17.13)
. (17.13)
В эту зависимость давление, при котором происходит реакция, не входит, следовательно, степень диссоциации в реакциях этого вида не зависит от давления.
Константа равновесия представляет гораздо более удобную расчетную величину, чем степень диссоциации, поэтому за основу расчета состава продуктов сгорания принимают именно константу равновесия и для нее даются таблицы значений 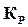 в зависимости от температур для разных реакций. В том случае, если нужно, то можно воспользоваться связью между
в зависимости от температур для разных реакций. В том случае, если нужно, то можно воспользоваться связью между 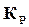 и
и 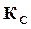 , т. е. формулой (17.9).
, т. е. формулой (17.9).
Дата добавления: 2015-04-03; просмотров: 5962;
