Равновесие в химических реакциях
Химическая реакция возможна только при условии соударения молекул реагирующих веществ между собой; при этом столкновении происходит перераспределение атомов, в молекулах и из исходных веществ получаются конечные. Рассмотрим простую часто применяемую в химической технологии реакцию, называемую иногда реакцией водяного газа
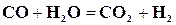 . (17.1)
. (17.1)
В этой реакции при столкновении молекулы окиси углерода с молекулой водяного пара атом кислорода отрывается от молекулы пара и присоединяется к молекуле окиси углерода, образуя молекулу углекислоты. По мере протекания реакции количество исходных веществ делается все меньше и скорость реакции уменьшается. Но с другой стороны, увеличивается количество полученной углекислоты и водорода, увеличивается количество столкновений молекул этих веществ и усиливается образование исходных веществ – окиси углерода и водяного пара, так как один атом кислорода опять передается от молекулы углекислоты молекуле водорода. Таким образом, всякая химическая реакция обратима и может идти в обоих направлениях, что обычно в химических уравнениях обозначается стрелками, т. е. уравнение (17.1) должно быть написано так:
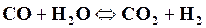 . (17.2)
. (17.2)
В действительности наблюдают только результат протекания двух противоположно направленных реакций. Если в реакции количество реагирующих между собой молекул 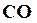 и
и 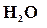 превышает количество реагирующих молекул
превышает количество реагирующих молекул 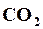 и
и 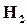 , то наблюдаем, что реакция идет слева на право, т. е. конечные вещества превращаются в исходные. Таким образом, направление реакции определяется, в основном, числом столкновений зависит от концентрации молекул этих веществ. Чем больше молекул исходных веществ прореагировало между собой, тем меньше остается не прореагировавших молекул, тем меньше концентрация исходных веществ, тем меньше скорость реакции.
, то наблюдаем, что реакция идет слева на право, т. е. конечные вещества превращаются в исходные. Таким образом, направление реакции определяется, в основном, числом столкновений зависит от концентрации молекул этих веществ. Чем больше молекул исходных веществ прореагировало между собой, тем меньше остается не прореагировавших молекул, тем меньше концентрация исходных веществ, тем меньше скорость реакции.
Концентрацию вещества в термохимии принято оценивать по количеству молей 1 м3
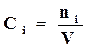 . (17.3)
. (17.3)
При протекании реакции концентрация исходных веществ уменьшается, и скорость реакции можно оценить по уменьшению концентрации того или иного вещества в единицу времени. Скоростью реакции называется количество молей вещества, прореагировавшее в1 м3 за 1 сек
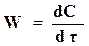 . (17.4)
. (17.4)
Концентрация газообразных продуктов реакции может быть выражена через их парциальные давления. Для этого воспользуемся уравнением состояния идеального газа, по которому
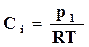 . (17.5)
. (17.5)
Дата добавления: 2015-04-03; просмотров: 1122;
