ВОЗБУДИТЕЛЬ ТУБЕРКУЛЕЗА, СТРОЕНИЕ, ИЗМЕНЧИВОСТЬ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА 13 страница
Плевроскопия. Операция торакоскопии, предложенная Jacobeus в 1910 г. для пережигания спаек у больных туберкулезом, в настоящее время модернизирована и рассматривается как диагностическое вмешательство с целью осмотра плевральной полости, легкого и выполнения биопсии. Плевроскопию проводят как при местном, так и общем обезболивании. Предварительно, за 1—2 дня, накладывают искусственный пневмоторакс, а при наличии плеврита экссудат заменяют воздухом. Торакоскоп вводят, как правило, в положении больного на здоровом боку в IV или V межреберье. Для выполнения биопсии измененной плевры или легкого вводят второй торакоскоп. При наличии фиб-робронхоскопа биопсию можно выполнить через один торакоскоп, так как фиброскоп имеет внутренний канал для проведения биопсийных щипцов. После осмотра плевры и легкого, а также выполнения биопсии торакоскоп извлекают, предварительно максимально удалив воздух из плевральной полости. Рану ушивают послойно. Диагностическая ценность плевроскопии при экссудативных плевритах неясной природы, рецидивирующих спонтанных пневмотораксах, саркоидозе и других поражениях как плевры, так и легочной ткани довольно высокая [Алиев М. А. и др., 1982].
4.9. ЦИТОЛОГИЧЕСКИЕ МЕТОДЫ
Для проведения дифференциальной диагностики туберкулеза и других заболеваний легких в клинической практике используют методику цитологического исследования мокроты.
У больных (особенно при активном процессе) мокрота гнойно-слизистая или слизисто-гнойная.
При цитологическом исследовании мазков весьма небольшое количество нейтрофилов выявляется в стадии выраженной дегенерации на фоне детрита типа казеозного, имеющего вид крупинок и окрашенного в темно-фиолетовый цвет. Характерны также скопления моноцитоидных мононуклеаров, крупных клеток с ядром неправильной формы и бледно-голубой протоплазмой. Среди них отмечаются формы, переходные к эпителиоидным.
Мононуклеарные клетки рассматривают как исходные элементы, из которых формируются эпителиоидные бугорки. Кроме того, в препаратах часто обнаруживают эозинофилы в значительных скоплениях. Увеличение количества эозинофилов у одних больных можно связать с приемом химиопрепаратов, обусловливающих эозинофи-лию в периферической крови и соответственно в мокроте, у других — с проявлением местных аллергических реакций на туберкулезную инфекцию. Наиболее характерными элементами туберкулезного воспаления в препаратах являются элементы туберкулезной гранулемы — эпителиоидные и гигантские клетки Пирогова — Лангханса. Чаще они обнаруживаются у больных с активной формой процесса, протекающего с распадом и выделением микобактерии туберкулеза.
Элементы специфического воспаления в мокроте выявляются в 14—32% наблюдений. Нередко при распаде обызвествленных очагов в легком можно обнаружить аморфные фосфаты в виде кристаллов желтоватого цвета различной величины. Учитывая дифференциально-диагностическое значение анализа мокроты, следует отметить, что цитология мокроты имеет существенное значение в диагностике бла-стоматозных процессов, некоторых диссеминированных поражений легких, симулирующих туберкулез (как канцероматоз), медиасти-нальной легочной форме лимфогранулематоза, гемосидероза и др.
С целью дифференциальной диагностики туберкулеза легких анализируют тканевый субстрат, аспирируемый эндобронхиальным методом и аспирационной биопсией легких. В случаях же поражений внутригрудных лимфатических узлов применяют метод трансбронхиальной пункционной игловой биопсии.
При катетеризационной биопсии материал представляет собой взвесь клеточных элементов в изотоническом растворе NaCl. Прежде чем исследовать этот материал, содержимое пробирки предварительно центрифугируют. Затем жидкость из пробирки сливают, а из осадка приготовляют мазки. Препараты изготовляют при вращательном движении по поверхности предметного стекла. С этой целью используют деревянные палочки либо пластиковые петли. После высыхания на воздухе в течение 30 мин препараты окрашивают по Райту—Романовскому, высушивают на воздухе и подвергают исследованию. Осадок по возможности используют целиком.
При взятии материала с помощью трансбронхиальной внутри-легочной щипцовой биопсии, игловой пункционной биопсии легких и внутригрудных лимфатических узлов, а также щеточной биопсии препараты готовит врач-бронхолог. При использовании щеточной биопсии, осторожно сняв полученный материал со щеточки иглой, размазывают его шлифованным стеклом по предметному стеклу. Так же приготовляют мазки из материала, полученного с помощью внутрилегочной щипцовой биопсии. При трансбронхиальной пункционной биопсии внутригрудных лимфатических узлов и аспирационной игловой биопсии легких материал выдувают из иглы при помощи поршня шприца на стекло, размазывают, высушивают на воздухе и окрашивают по Райту—Романовскому.
При исследовании соскоба со слизистой оболочки бронхов полученный материал снимают с кусачек и на месте приготовляют препараты-мазки. После высушивания на воздухе их направляют в лабораторию, где окрашивают и затем исследуют. Метод отпечатков мазков применяют при исследовании резецированного кусочка ткани. Такие мазки приготовляют путем осторожного прикладывания предметного стекла к материалу. Для получения более качественного препарата мы рекомендуем производить соскоб скальпелем, затем его размазывать на предметном стекле.
При обработке препаратов-отпечатков со слизистой оболочки бронхов материал, полученный с помощью ватных тампонов при бронхоскопии, тотчас размазывают на предметном стекле. В течение 5—10 мин препараты высушивают на воздухе и доставляют в лабораторию.
При исследовании биоптатов и аспиратов в случае туберкулезного процесса с творожистым перерождением выявляется характерный признак — наличие казеозного детрита, располагающегося в виде аморфных масс темно-фиолетового цвета. В детрите часто обнаруживаются соли извести в виде кристаллов различной величины, слегка опалесцирующих, с бледновато-желтоватым оттенком. При разжижении казеозных масс отмечается детрит с наличием небольшого количества нейтрофилов в стадии дегенерации. Казеозный детрит чаще наблюдается при туберкулемах в фазе распада, первичном туберкулезе и натечных абсцессах. Кроме того, для туберкулеза характерно наличие неизмененных и в стадии фиброзиро-вания эпителиоидных бугорков и гигантских клеток типа клеток Пирогова—Лангханса (рис. 4.6, 4.7).
Все большее распространение получают исследования бронхоаль-веолярных смывов (БАС). На основании цитограммы БАС можно установить степень активности процесса, провести коррекцию терапии и уточнить характер заболевания. Рекомендуется одновременно производить обзорный просмотр препаратов, что дает возможность в ряде случаев выявить специфические элементы для определенной нозологии.
Для подсчета общего количества клеток в 1 мл БАС 10 капель профильтрованного смыва смешивают на часовом стекле с каплей жидкости Самсона. Этой смесью заполняют счетную камеру. Клеточные элементы подсчитывают во всей камере без учета клеток бронхиального эпителия и определяют их число в 1 мл смыва. Оставшийся профильтрованный БАС центрифугируют при комнатной температуре в течение 10 мин со скоростью 1500 об/мин. Из осадка готовят мазки, которые высушивают на воздухе и затем окрашивают в течение 4—5 мин по гематологической методике. Клеточный состав БАС определяют на основании подсчета не менее 500 клеток. При этом учитывают альвеолярные макрофаги, лимфоциты, нейтрофилы, эозинофилы. Клетки бронхиального эпителия во внимание не принимают. Соотношение клеток БАС в норме составляет: макрофаги — 90—93%, нейтрофилы — 0—1%, лимфоциты — 5—10% [Bergmann, 1981; Davis et al., 1982].
У больных туберкулезом эндопульмональная цитограмма характеризуется преимущественно повышенным уровнем нейтрофилов, а при саркоидозе имеет место лимфоцитарный тип. При этом высокое содержание лимфоцитов отмечается в активной фазе процесса.
Рис 4 6 Препарат материала катетер-биопсии легких Казеозный детрит при туберкулезе легких * 730
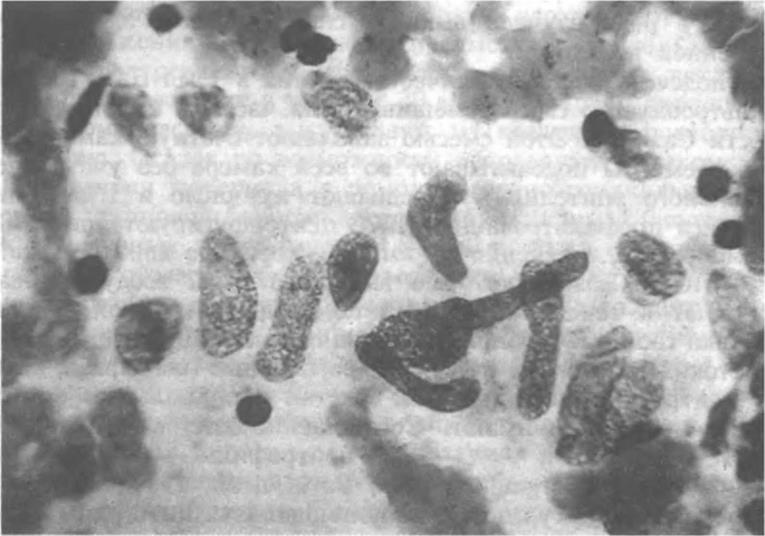
Рис 4 7 Препарат материала трансбронхиальной внутриклеточной био псии Эпителиоидные клетки * 730
4.10. БИОХИМИЧЕСКИЕ МЕТОДЫ
Биохимические методы позволяют оценить состояние систем гуморальной регуляции и отдельных звеньев обменных процессов, функциональное состояние эндокринных и паренхиматозных органов. Из сочетания этих компонентов складывается индивидуальное состояние неспецифической реактивности организма больного, которое определяется генетическими факторами, возрастом, наличием сопутствующих заболеваний, аллергией, а также фазой, длительностью и распространенностью туберкулезного процесса в легких.
Биохимические исследования, проводимые в разные периоды наблюдения за больными, имеют различные задачи. При первом контакте больного с врачом решаются вопросы установления диагноза, определения активности и остроты туберкулезных изменений в легких, выбора оптимальных методов специфической и патогенетической терапии. Биохимические сдвиги при развитии любого воспалительного процесса по своей природе неспецифичны, ни один из биохимических тестов не может служить абсолютным диагностическим критерием.
Для оценки наличия и остроты воспалительного процесса в минимальный комплекс исследований целесообразно включить определение количества гаптоглобина, церулоплазмина, С-реактивного белка (СРБ). С целью выявления скрытой реактивности туберкулезного процесса А. Е. Рабухин и Р. А. Иоффе предложили белко-вотуберкулиновую пробу. Белковые фракции сыворотки крови определяют до подкожного введения 20 ТЕ ППД-Л и через 48 ч после введения. При наличии скрытой активности под влиянием туберкулина воспаление в очагах «оживляется», что отражается в увеличении количества «2-глобулиновой фракции; проба считается положительной при увеличении «2-глобулинов более чем на 10% от исходного уровня. Чувствительность пробы умеренная, особенно у взрослых больных. Более чувствительным туберкулино-провокаци-онный тест оказывается при использовании в качестве контрольного показателя содержания гаптоглобина. Оценка результатов аналогична приведенной выше. При увеличении содержания гаптоглобина не менее чем на 10% проба считается положительной.
Поскольку в последние годы наблюдается тенденция к нарастанию частоты сочетания туберкулеза с сахарным диабетом, у всех больных при поступлении в стационар необходимо определять содержание глюкозы в крови. При пограничных значениях, превышающих 5,55 ммоль/л (верхняя граница нормы), необходимо проводить пробу на толерантность к глюкозе (нагрузка 50 г глюкозы с последующим определением уровня ее в крови через 1 и 2 ч). Для оценки состояния печени необходимо иметь представление о целостности ее паренхимы, а также о состоянии желчевыделитель-ной, антитоксической и синтетической функций.
Наиболее широкое распространение для диагностики паренхиматозных повреждений печени получило определение активности аланин- и аспартатаминотрансфераз (АЛаТ и АСаТ). АСаТ содержится не только в гепатоцитах, но и в клетках миокарда и поперечнополосатых мышц. Поэтому при инфаркте миокарда и массивной травме мышечной ткани (например, при операции) активность этого фермента в крови может кратковременно нарастать у больных с неповрежденной печенью. Значительно более специфичным для паренхиматозных повреждений печени является повышение активности АЛаТ и отношения АСаТ/АЛаТ, которое в норме колеблется в пределах 1. Возрастание активности аминотрансфераз в пределах удвоенной нормы обычно свидетельствует об умеренно выраженных повреждениях, а выше удвоенной и тем более утроенной нормы — о развернутой картине паренхиматозного гепатита. Увеличение активности лактатдегидрогеназы-5 (ЛДГ5) на фоне положительной динамики легочного процесса и субъективно хорошей переносимости лечения служит ранним признаком начальных лекарственных повреждений гепатоцитов до их клинического проявления. Определяют активность и других ферментов, органоспецифических исключительно для печени (фруктозо-1-монофосфатальдолаза, урокининаза).
Определенное представление об антитоксической функции печени дает фракционное исследование билирубина крови. Если процесс связывания билирубина в печени нарушен, то в крови умеренно повышается содержание непрямого (свободного) билирубина, тогда как прямая реакция остается отрицательной. Аналогичная ситуация может сложиться при значительном гемолизе, когда печень не успевает «справляться» с большим количеством поступающего свободного билирубина (гемолитическая желтуха). Однако значительный гемолиз обычно имеет и другие проявления (анемия, возникновение молодых форм эритроцитов). Вне гемолиза увеличение уровня непрямого билирубина при отрицательной прямой реакции свидетельствует о нарушении антитоксической функции печени (способность образовывать парные соединения) и часто сопутствует (а иногда и предшествует) развитию побочных реакций на противотуберкулезные препараты.
Вариантом оценки антитоксической функции печени служит изучение ее экскреторной функции, которое проводят при помощи бромсульфалеиновой пробы. Эта проба очень чувствительна, проста в исполнении и позволяет получить достоверные данные для прогноза и раннего выявления побочного действия лекарств.
О нарушении желчевыделительной функции печени (холестаз) свидетельствует повышение в крови содержания тех соединений, которые являются нормальными компонентами желчи (прямой билирубин, щелочная фосфатаза, у-глутамилтранспептидаза, /З-липо-протеиды). Если количество этих соединений возрастает, а активность аминотрансфераз остается в пределах нормы, то следует думать о холестазе, если имеется одновременное повышение обоих показателей — о паренхиматозном гепатите.
Паренхиматозные изменения чаще возникают в результате применения гепатотоксичных лекарств, а явления холестаза — при развитии токсико-аллергических реакций на любые препараты.
Пробы на коллоидную устойчивость сывороточных белков помогают выявить как паренхиматозный, так и интерстициальный (па~ распецифический, токсико-аллергический) гепатит. Вариантами этих проб являются сулемовая, проба Вельтмана, реакция Таката — Ара, тимоловая проба.
При развитии лекарственной аллергии к любым препаратам нередко в процесс вовлекаются почки, развиваются аллергические гломерулиты и васкулиты. Поэтому функциональное исследование почек необходимо не только до начала лечения, но и в процессе его. Показаниями к таким повторным исследованиям служат применение потенциально нефротоксичных антибиотиков (через 2 мес после начала лечения и затем ежемесячно) и развитие выраженных аллергических реакций на любые препараты (в ближайшие 1—2 дня после реакции).
Минимальную и в то же время достаточную для оценки состояния почек информацию дает определение их фильтрационной, концентрационной и азотовыделительной функций. Всем этим требованиям отвечает проба Реберга—Тареева, дополненная определением уровня мочевины или остаточного азота крови.
При первом исследовании умеренное снижение примерно до 60 мл/мин начального процесса мочеобразования — клубочковой фильтрации — может сопутствовать инфильтративной фазе туберкулезного процесса (токсико-инфекционная почка). Такое снижение не является противопоказанием к применению потенциально нефротоксичных антибиотиков, а по мере снятия явлений туберкулезной интоксикации величина клубочковой фильтрации нередко нарастает. Снижение фильтрации в процессе лечения следует рассматривать как проявление побочного действия лекарств. Исходная клубочковая фильтрация ниже 60 мл/мин отражает наличие осложнений туберкулеза (амилоидоз, сердечная недостаточность) или сопутствующих почечных заболеваний. Во всех этих случаях, кроме сердечной недостаточности, назначение потенциально нефротоксичных антибиотиков нежелательно, так как, во-первых, при исходной почечной патологии чаще выявляется их нефротоксическое действие, а во-вторых, указанные антибиотики выделяются из организма преимущественно по механизму клубочковой фильтрации и при значительном снижении последней возможна кумуляция препаратов в организме с нарастанием их ототоксического эффекта. При развитии лекарственной аллергии, а также в ранних стадиях амилоидаза (в обоих случаях за счет повышения проницаемости клубочкового фильтра) иногда наблюдается патологическое увеличение клубочковой фильтрации — более 150 мл/мин.
Снижение концентрационной способности почек, о чем свидетельствует уменьшение реабсорбции воды в канальцах ниже 97% и концентрационного индекса эндогенного креатинина ниже 40, всегда говорит о значительной давности и распространенности патологического процесса в почках и функциональной неполноценности почек.
Азотовыделительная функция почек не нарушается длительно, пока сохраняется не менее 30% почечной паренхимы. Поэтому увеличение количества азотистых шлаков крови в процессе лечения (и даже в пределах нормы) должно привлекать внимание, а превышение верхней границы нормы всегда свидетельствует о почечной недостаточности.
Следующим аспектом исходного биохимического исследования является оценка способности организма больного метаболизировать лекарства. Как эффект лечения, так и частота и выраженность побочных реакций токсического характера в значительной степени определяются «высотой» максимальных концентраций и длительностью циркуляции лекарственных препаратов в крови, а также путями их обезвреживания (инактивации). Так, темп ацетилирования ГИНК в организме при полноценном функционировании печени генетически детерминирован, не изменяется с возрастом и в процессе лечения. Все люди по скорости, с которой у них происходит аце-тилирование ГИНК, делятся на быстрых и медленных инактиваторов (ацетиляторов). У медленных инактиваторов в метаболизм ГИНК включаются процессы микросомного окисления в печени, при этом образуются продукты, более токсичные, чем ацетилизониазид. Свободный ГИНК и продукты его метаболизма выводятся почками, поэтому по содержанию этих соединений в моче (суточной или порционной) можно судить о характере инактивации препарата в организме. Установление типа инактивации целесообразно проводить в самом начале для определения режима лечения (дозы, ритм).
Среди систем гуморальной регуляции большое внимание на формирование неспецифической реактивности оказывает состояние кал-ликреин-кининовой системы крови (КС). КС в организме выполняет функцию физиологической адаптации кровообращения к изменяющимся условиям внешней и внутренней среды. Локальная активация КС обусловливает местную гиперемию, повышение сосудистой проницаемости, хемотаксис нейтрофилов. По сути это является защитной реакцией при повреждении тканей, но при нарушении физиологического контроля внутри системы может выступить в качестве неуправляемого фактора воспаления. При аллергических реакциях образование комплексов антиген—антитело приводит к генерализованной активации КС с тотальным повышением сосудистой проницаемости и снижением артериального давления.
Ранним фазам активного туберкулезного процесса в легких сопутствует адаптивная компенсированная активация КС, что проявляется в равномерном сбалансированном увеличении содержания всех ее компонентов (предшественников, кининообразующего фермента калликреина, кининразрушающих ферментов). У лиц с сомнительной активностью патологического процесса при подкожном введении 20 ТЕ ППД-Л через 24 ч наблюдается отчетливое повышение уровня калликреина, а через 48 ч увеличивается активность кининразрушающей кининазы I, что позволяет использовать этот тест как один из вариантов туберкулинпровокационных проб. При развитии деструкции, выраженной интоксикации, генерализации процесса, на высоте аллергических и токсико-аллергических лекарственных реакций КС активируется из-за высокого уровня калликреина при подавлении активности кининразрушающих ферментов (иногда с истощением предшественников). Такое состояние КС служит патогенетическим фактором в развитии указанных состояний и требует лекарственной коррекции антикининовыми препаратами [Каминская Г. О. и др., 1979; Свистунова А. С, 1980; Макинский А. И., 1981; Келеберда К. Я. и др., 1982].
Не меньшее значение в формировании характера ответной реакции организма на внедрение возбудителя туберкулеза имеет система универсальных биорегуляторов простагландинов (ПГ) и «сопряженных» с ними внутриклеточных посредников в действии на клетки гормонов и биологически активных веществ — циклических нуклеотидов (цАМФ и цГМФ). ПГ различных классов (Е и F2a
оказывают сильное и разнонаправленное действие как на состояние сосудистой проницаемости и хемотаксис фагоцитирующих клеток, так и на реакции клеточного иммунитета. Благоприятному течению туберкулезного процесса сопутствует сбалансированный рост уровня ПГ Е и F2a- При прегрессировании процесса физиологические соотношения между обоими классами ПГ нарушаются [Сокол Т. В., 1984].
Существенное влияние на состояние неспефической реактивности оказывает усиление процессов перекисного окисления липидов (ПОЛ). При туберкулезной интоксикации такое усиление приобретает универсальный характер, отрицательно влияя на течение локального процесса, толерантность к туберкулостатикам и выраженность остаточных фиброзных изменений. Биохимические методы позволяют оценить интенсивность ПОЛ по количеству начальных и конечных продуктов этого процесса (диеновые конъюгаты, малоновый диальдегид) и степень эндогенной антиоксидантной защиты (антиокислительная активность, содержание в крови естественного антиоксиданта «-токоферола). Выраженность и сбалансированность процессов ПОЛ четко коррелируют с фазой туберкулезного процесса и степенью интоксикации и вместе с тем служат обоснованием и критерием для применения антиоксидантной терапии.
Деятельность систем гуморальной регуляции в значительной степени детерминирована функциональным состоянием коры надпочечников. Вследствие адаптивной природы деятельности данного органа при свежих формах туберкулеза легких функция коры надпочечников «возбуждается», что увеличивает продукцию как противовоспалительных глюкокортикоидов, так и провоспалительных минералокортикоидов. Соотношение между выделением этих двух классов гормонов у различных больных может сильно варьировать. При относительном преобладании противовоспалительных глюкокортикоидов создаются предпосылки для отграничения процесса и торпидного его течения, а избыток минералокортикоидов (дискор-тицизм), напротив, обусловливает экссудативный характер процесса, склонного к прегрессированию. Кроме того, при последнем варианте соотношений кортикостероидов значительно выше возможность развития побочных реакций на противотуберкулезные препараты [Гурьева И. Г., 1974].
При известной продолжительности процесса и выраженности интоксикации функциональные резервы коры надпочечников постепенно истощаются. Вначале это истощение носит латентный характер: содержание гормонов в крови и экскреция их с мочой повышены. Однако такой уровень предельный, и при нагрузке АКТГ функция коры надпочечников не усиливается, иногда наблюдается парадоксальный эффект. При стрессе (операция) может развиться острая сердечно-сосудистая недостаточность вплоть до коллапса и шока.
У больных с хроническими формами туберкулеза легких при большой продолжительности заболевания полностью истощаются функциональные резервы коры надпочечников, и орган уже не может не только адекватно ответить на дополнительную нагрузку, но и обеспечить стабильный физиологический уровень гормонов в крови. В таких условиях возникает состояние гипофункции коры надпочечников (гипокортицизм, «малый аддисонизм»), выявляемое клинически и создающее предпосылки к острому прогрессирующему течению туберкулезного процесса в легких и низкой толерантности к туберкулостатикам. Если состояние латентной гипофункции надпочечников приобретает большое значение в хирургической практике, то клинически выявляемый гипокортицизм предопределяет необходимость в гормонотерапии у терапевтических больных.
Биологическим материалом для исследования функционального состояния коры надпочечников служат кровь и моча. Поскольку у человека кортикостероидные гормоны и их метаболиты выделяются почками, по их содержанию в суточной моче можно оценить уровень экскреции (и соответственно, секреции). С мочой выделяются как продукты полного метаболизма гормонов 17-кетосте-роиды (17-КС), так и неизмененные гормоны или метаболизиро-ванные частично с сохранением их биологических свойств — 17-оксикортикостероиды (17-ОКС). Определение только суточной экскреции 17-КС, нередко рекомендуемое для оценки функционального состояния коры надпочечников у больных туберкулезом, недостаточно информативно, поскольку 17-КС образуются в печени, а при ее недостаточности синтез и выделение гормонов могут падать, количество же неметаболизированных активных гормонов, циркулирующих в крови, напротив, увеличивается. Кроме того, 17-КС являются продуктами метаболизма не только корти-костероидов, но и мужских половых гормонов. Поэтому полное представление о «размерах» секреции гормонов корой надпочечников дает лишь определение суточной экскреции одновременно 17-КС и 17-ОКС. При этом высокий уровень экскреции данных соединений может маскировать состояние латентной недостаточности, которое выявляется только путем двукратных исследований до и после 3-дневной нагрузки АКТГ. Определение в крови суммарного содержания 17-ОКС, их свободных и белковосвязанных форм, а также концентраций гидрокортизона и кортикостерона (или альдостерона) позволяет определять биологическую активность циркулирующих гормонов и взаимоотношение между их глюкокортикоидным и минералокортикоидным компонентами.
4.11. ИММУНОЛОГИЧЕСКИЕ МЕТОДЫ
Оценка состояния основных систем иммунитета, определение их клеточных структур, а также степени развития специфических иммунологических реакций могут помогать в решении ряда задач в клинике туберкулеза: активность процесса, характер течения заболевания, дифференциальная диагностика. Уточнение иммунологического статуса больного важно перед оперативным вмешательством, а также при определении показаний к назначению иммуномодуля-торов. Иммунологические методы применяют для диагностики лекарственной непереносимости, возникающей в процессе химиотерапии. Для оценки иммунного статуса больных используют набор иммунологических методов: тесты оценки состояния Т- и В-лимфоцитов и их субпопуляций (особенно регуляторных) с количественной характеристикой и определением функциональной активности им-мунокомпетентных клеток, определение сенсибилизированных к соответствующим антигенам Т- и В-лимфоцитов или их продуктов (медиаторов и антител).
Ценную информацию могут дать исследования, направленные на обнаружение антигенов микобактерии или других микроорганизмов в таком наиболее доступном материале, как кровь [Авербах М. М. и др., 1984]. Важное значение имеет определение факторов неспецифической реактивности, к которым относятся, например, различные компоненты системы комплемента. Широко используются также реакции для определения функции фагоцитов (полинуклеаров и макрофагов, особенно альвеолярных) при легочных заболеваниях, а также различных сывороточных белков, гормонов и др.
Тесты количественной и функциональной оценки Т-лимфоцитов и их субпопуляций. Розеткообразование с бараньими эритроцитами. Установлено, что розетки с эритроцитами барана образуют Т-лимфоциты [Чередеев А. Н., 1976; Jondal М. et al., 1972 ]. Для постановки данного теста выделяют лейкоцитарную массу путем отстаивания гепаринизированной или дефибринированной крови (спонтанное отстаивание или с добавлением желатина), затем лейкоциты осаждают центрифугированием либо лимфоциты выделяют из цельной крови центрифугированием в градиенте фиколл/ге-пак (уротраст, изопак, верографин). После этого лимфоциты соединяют с эритроцитами барана и через определенный срок инкубации готовят мазки, которые фиксируют глутаровым альдегидом и окрашивают азур-эозином (или просматривают в камере Горяева нативные препараты). В препаратах определяют процент лимфоцитов, образовавших розетки с эритроцитами (не менее 3 эритроцитов, прикрепившихся к одному лимфоциту). Рекомендуется также пересчет количества розеткообразующих клеток в абсолютных показателях (так как число лимфоцитов в крови при различной патологии, естественно, имеет большие колебания). В норме в крови обнаруживается 50—70% розеткообразующих Т-клеток.
Для определения и подсчета Т-лимфоцитов используют моно-клональные антитела (ОКТ или других серий) против маркеров
Т-лимфоцитов. Проба состоит из этапов добавления моноклональных антител к взвеси лимфоцитов, антисыворотки против иммуноглобулинов, включающей, например, радиоактивную или флюоресцирующую метку, с последующей ее регистрацией.
Реакция стимуляции Т-лимфоцитов митогена-ми. Показано, что ряд митогенов, в первую очередь таких, как фитогемагглютинин (ФГА) и конканавалин А (кон-А), вызывают бласттрансформацию и митозы Т-лимфоцитов [Ling М., 1975]. Для постановки теста с ФГА лейкоциты или лимфоциты выделяют описанным выше способом и затем культивируют в присутствии ми-тоге на в течение 72 ч. По окончании культивирования готовят мазки, которые окрашивают азур-эозином или другим методом и определяют процент бластных клеток (молодых клеточных форм) и/или митозы. В норме в культурах с ФГА обнаруживается 60—95% бластных клеток.
Другим способом оценки активации лимфоцитов под действием митогенов является определение включения 3Н-тимидина (или других меченых предшественников нуклеиновых кислот или аминокислот) в ДНК. 3Н-тимин добавляют в культуры лимфоцитов за 2—12 ч до конца культивирования. После инкубации клеточную массу отмывают, лизируют NaOH, гиамином или растворителем NCS (для выхода включенной радиоактивности в жидкость), помещают в сцин-тилляционную жидкость и определяют число импульсов в опыте (культура с ФГА) и контроле (без ФГА) в жидкостном сцинтилля-ционном счетчике (например, отечественный счетчик СБС).
Дата добавления: 2015-04-25; просмотров: 1400;
