ВОЗБУДИТЕЛЬ ТУБЕРКУЛЕЗА, СТРОЕНИЕ, ИЗМЕНЧИВОСТЬ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА 10 страница
Кроме того, в мазках из осадка мочи, промывных вод желудка и другого материала наряду с микобактериями туберкулеза могут обнаруживаться и кислотоустойчивые сапрофиты, в частности в моче — микобактерии спермы, которые легко спутать с микобактериями туберкулеза. В сомнительных случаях рекомендуется мазок длительно (45—60 мин) обесцвечивать в солянокислом спирте или жавеловой воде. При таком методе обесцвечивания сапрофиты теряют свою окраску и выгладят в виде палочек голубого цвета (в результате докрашивания мазка после обесцвечивания мети-леновым синим).
Правильная микроскопия препаратов является ответственной процедурой и требует высокой квалификации и большого опыта микро-скописта, так как на основании результатов микроскопии ставится диагноз, уточняются эффективность лечения и прогноз заболевания.
Микроскопию окрашенных препаратов производят в световом микроскопе с иммерсионным объективом *90 и окуляром *10 (увеличение *900). Желательно использовать бинокулярный микроскоп с объективом *100. На просмотр обычно требуется в среднем около 5 мин. Этого времени достаточно, чтобы просмотреть не менее 100 полей зрения и обнаружить единичные микобактерии. Согласно рекомендациям Международного союза по борьбе с туберкулезом (1976), просмотр препарата следует начинать в центральной части левого края мазка, постепенно передвигаясь вправо вдоль длинной оси мазка. Подсчитано, что просмотрев последовательно в этом направлении 100 полей зрения, микроскопист продвинется на 2 см. В некоторых случаях бактериоскопическое исследование 100 полей зрения оказывается недостаточным (см. ниже) для обоснованного заключения о количестве возбудителей, выделяемых больным. В таких случаях рекомендуется исследовать не менее 300 полей зрения по схеме, приведенной на рис. 4.1.
В последние годы довольно широкое распространение получил метод люминесцентной микроскопии. Он основан на различии свечения микроскопируемого объекта в ультрафиолетовом или коротковолновом спектре видимого света. В основе применения этого метода для дифференциации микобактерии туберкулеза лежит способность липидов этих бактерий воспринимать люминесцентные красители и затем светиться при облучении ультрафиолетовыми лучами. В зависимости от применяемых красителей микобактерии туберкулеза дают четкое ярко-красное свечение на зеленом фоне или золотисто-желтое — на темно-зеленом фоне. Этим методом можно исследовать любой материал, кроме мочи, в которой могут быть сапрофиты, трудно дифференцируемые при такой окраске. Последние имеют зеленоватый или апельсиновый оттенок. Наиболее широко распространены методы окраски акридиновым оранжевым по Адам-чику и окраски аурамином-родамином.
При микроскопии мазков по люминесцентному методу высокая контрастность микроскопической картины дает возможность проводить исследования при малых увеличениях (объектив х40, окуляр х10). При такой микроскопической системе увеличивается одномоментно просматриваемое поле зрения (по сравнению с иммерсионной микроскопией). Это позволяет выявлять единичные микобактерии и делает люминесцентный метод особенно ценным при исследовании олигобациллярного материала. Люминесцентная микроскопия значительно сокращает время, затрачиваемое на нахождение единичных микобактерии туберкулеза, позволяет быстро просмотреть весь препарат и, следовательно, повысить число находок.
Рис. 4.1. Схема бактериоскопии.
Сравнительные исследования одних и тех же препаратов, окрашенных по методу Циля — Нильсена и люминесцентными красителями, показали значительно более высокую информативность люминесцентного метода, которая, по данным различных авторов, колеблется от 9—10 до 19%.
Положительный неколичественный ответ микроскопии обычно дается в том случае, если в препарате обнаруживается не менее 3 микобактерии. Однако в случае положительного результата однозначного ответа «положительный» или «отрицательный» в настоящее время для клинических целей недостаточно. Применяется количественная оценка массивности бактериовыделения.
Количество обнаруженных в мазках микобактерии является весьма важным показателем, отражающим степень заразности больного. В современной химиотерапии легочного туберкулеза количественная оценка бактериовыделения служит одним из методов определения эффективности лечебных мероприятий. Уменьшение в процессе химиотерапии вегетирующей микобактериальной популяции трактуется как хороший прогностический признак, тогда как длительное стабильное бактериовыделение или тенденция к его увеличению рассматривается как неудачи лечения и требует незамедлительной смены лечебной тактики.
Для количественной оценки микобактериальной популяции используют бактериоскопический и культуральный методы. Результативность этих методов близка, но неравнозначна. Быстрота получения информации при применении бактериоскопического метода составляет его неоспоримую ценность по сравнению с культуральным методом. Однако последний более полноценно характеризует микробную популяцию не только с количественной, но и с качественной стороны.
Установлено, что результаты многократных бактериоскопических исследований патологического материала приближаются к результативности метода посева, особенно у больных с хроническими деструктивными формами туберкулеза. Применение двух методов в совокупности позволяет более точно количественно оценить степень бактериовыделения.
В основу применяемых в настоящее время методов количественного
учета микобактерии в препарате положен метод, предложенный учениками Коха — Гаффкой и Стинкеным. Этот метод вошел в литературу как метод Гаффки в модификации Стинкена. Собирается мокрота, выделяемая больным за 24 ч. После измерения ее количества мокрота подвергается обработке и засевается на питательные среды с помощью количественного метода, а из осадка, кроме того, приготавливается мазок. Для этого на предметное стекло наносят 0,05 мл осадка мокроты, и это количество распределяют в виде мазка диаметром 15 мм на заранее откалиброванном на стекле участке. Мазок окрашивают по Цилю — Нильсену и просматривают в микроскопе не менее 100 полей зрения. Число микобактерии в каждом поле зрения записывают в специальной сетке. Затем подсчитывают среднее число микобактерии в одном поле зрения. Японскими авторами установлено, что при диаметре мазка 15 мм и увеличении микроскопа 630 раз (окуляр *7, объектив *90) в таком мазке содержится постоянное число полей зрения, соответствующее 10 000. Для определения числа микобактерии предложена специальная формула Берче (1969). Путем сравнительно несложных расчетов по ней можно определить общее число микобактерии, выделяемых больным с мокротой ежесуточно в зависимости от количества мокроты.
Однако следует признать, что метод Гаффки — Стинкена довольно сложен, требует много времени и большой точности. Поэтому предложены различные модификации этого метода, облегчающие его выполнение и ускоряющие исследование. Так, в Центральном НИИ туберкулеза РАМН разработана комплексная методика количественного определения массивности бактериовыделения (КОМБ), которая предусматривает одновременное использование бактериоско-пического и культурального методов. В схему исследования входит бактериоскопия дозированного мазка из осадка мокроты, окрашенного по Цилю -— Нильсену, определение числа микобактерии в 100 полях зрения, посев материала на питательные среды Левенштей-на -— Иенсена и Финна-Н с последующим подсчетом выросших колоний. Массивность микробной популяции при баатериоскопии оценивают по двум степеням: 1) скудное бактериовыделение — в дозированном мазке обнаруживается 1-—9 микобактерии в 100 полях зрения; 2) обильное — от 10 до 100 микобактерии в 100 полях зрения.
Существуют и другие схемы оценки массивности бактериовыделения. Международный союз по борьбе с туберкулезом придерживается следующей схемы количественной оценки. Подсчет выявляемых кислотоустойчивых микобактерии производят в пределах до 50 микробных особей при микроскопии по схеме, приведенной на рис. 4.1. При этом могут наблюдаться следующие варианты.
1. Обнаружено 50 микобактерии менее чем в 100 полях зрения, т. е. раньше, чем микроскопист завершил просмотр одной длины мазка. Запись: более 50 в 1 длине — >50/100 в поле зрения;
2. От 10 до 50 микобактерии обнаружено в 1 длине мазка. Указывается абсолютное число: 36/100 в поле зрения.
3. От 0 до 10 микобактерии обнаружено в 1 длине мазка.
В этом случае необходимо продолжить исследование и просмотреть 3 длины (300 полей зрения). Возможны 3 варианта:
а) обнаружено 50 микобактерии; запись 50/>100 в поле зрения;
б) обнаружено менее 50 микобактерии; указывается их количе-
ство: 29/300 в поле зрения;
в) не обнаружено микобактерии; запись: 0/300 в поле зрения.
Можно провести аналогию этих результатов с более привычными
для нас понятиями обильного (массивного), умеренного и скудного бактериовыделения:
>50/100 в поле зрения — соответствует обильному,
10—50/100 в поле зрения — умеренному и
50/300 в поле зрения — скудному бактериовыделению.
Клиническое значение определения массивности бактериовыделения не вызывает сомнений. Установлена прямая корреляция между массивностью микобактериальной популяции, частотой развития лекарственной устойчивости микобактерии и объемом деструктивного процесса у больных туберкулезом. У лиц с хроническими формами туберкулеза легких при ограниченных деструктивных поражениях отмечается менее интенсивное бактериовыделение (у 50% больных наблюдается отсутствие или небольшое число микобактерии в мокроте), более редкое развитие лекарственной устойчивости к противотуберкулезным препаратам и более частое прекращение бактериовыделения в процессе лечения. При распространенном деструктивном туберкулезе легких большинство больных выделяют массивную бактериальную популяцию, содержащую в 63—78% случаев устойчивых в противотуберкулезным препаратам микобактерии. У этих больных в 2 раза реже наступает прекращение бактериовыделения в результате химиотерапии. Сроки исчезновения микобактерии туберкулеза из мокроты в определенной степени коррелируют с массивностью бактериовыделения до начала химиотерапии.
Отмечено, что положительная бактериологическая динамика, проявляющаяся в резком снижении микобактериальной популяции и полном ее исчезновении из мокроты, несколько опережает рент-геноморфологические признаки инволюции процесса. Именно в этот период на фоне исчезновения типичных бактериальных форм возбудителя наиболее легко и демонстративно выявляются разнообразные качественные изменения микобактерии, проявляющиеся в возникновении различных форм биологической изменчивости микроба.
Следует отметить также, что на фоне интенсивной противотуберкулезной химиотерапии (особенно с включением в состав лечебных комбинаций рифампицина) в последние годы отмечается феномен появления в мазках из разнообразного патологического материала видимых под микроскопом и хорошо окрашивающихся по Цилю — Нильсену микобактерии, которые под влиянием лечебных препаратов на самом деле утратили жизнеспособность и способность размножаться на питательных средах. Этот феномен получил в литературе название «видимые, но нерастущие микобактерии». Для выявления этих микроорганизмов японские исследователи Murohashi и Yoshida (1957) предложили метод окраски «на живые и мертвые».
Метод основан на различной окраске ДНК микробной клетки у живых и погибших микобактерии. В последних она находится в деполимеризованном состоянии и теряет способность окрашиваться некоторыми анилиновыми основными красителями (в частности, метиленовым зеленым), однако воспринимает дополнительную окраску пиронином, сафронином или карболовым фуксином. На окрашенном препарате живые жизнеспособные микобактерии зеленые, а погибшие, не способные к размножению, — красные.
Таким образом, для обнаружения микобактерии имеется несколько бактериоскопических мазков. Они достаточно просты, общедоступны и позволяют получить ответ в максимально короткий срок. Однако они не дают полной уверенности ни при положительном, ни при отрицательном результате бактериоскопии и потому, как правило, сопровождаются более чувствительным и результативным методом исследования — методом посева.
Метод посева, или культуральный метод выявления микобактерии. Этот метод отличается большой чувствительностью и имеет ряд преимуществ перед методом микроскопии. Он позволяет выявить микобактерии туберкулеза при наличии в исследуемом патологическом материале нескольких десятков жизнеспособных особей. Если сопоставить эту цифру с 10 000—100 000 микробных тел, присутствие которых необходимо в 1 мл материала для бактериоскопиче-ского выявления, то станет ясна значительно более высокая чувствительность метода посева. Это особенно важно при исследовании материала от впервые выявленных или уже леченных больных, выделяющих малые количества микобактерии.
Очень важным преимуществом метода культурального исследования является возможность получения культуры возбудителя, которая может быть подробно исследована, идентифицирована и изучена в отношении ее лекарственной чувствительности, вирулентности и других свойств. Однако необходимо отметить, что существует ряд факторов, ограничивающих широкое применение метода культивирования, в частности его высокая стоимость, известные ограничения, связанные со сложностью обработки патологического материала, медленным размножением микобактерии туберкулеза и, следовательно, необходимостью долго ждать результатов исследования. Все это снижает ценность метода, не дает возможности оперативно использовать полученные результаты в клинике и диктует необходимость проведения широкого поиска как более совершенных методов, так и более совершенных питательных сред, которые позволили бы ускорить получение результатов и повысить эффективность и чувствительность метода.
Бактериологическому исследованию подвергается самый разнообразный материал: мокрота, промывные воды бронхов и желудка, экссудаты, отделяемое ран и свищей, моча, спинномозговая жидкость, материалы биопсии и бронхоальвеолярного лаважа, органы экспериментальных животных и патологоанатомический материал. Материал для исследования должен доставляться в лабораторию в стерильной хорошо закрытой посуде. Перед посевом на питательные среды материал предварительно обрабатывают, что преследует двоякую цель: 1) максимально гомогенизировать материал, подлежащий исследованию, с тем чтобы содержащиеся в нем микобактерии равномерно распределились в его объеме, чем облегчается их выделение; 2) необходимо «подавить» все другие микроорганизмы (гноеродные и гнилостные), содержащиеся в материале исследования, с тем чтобы в дальнейшем они как более быстро растущие не мешали росту микобактерии и не использовали приготовленные для микобактерии питательные вещества среды.
С этой целью для обработки патологического материала перед посевом на питательные среды используют различные реактивы. Это должно обеспечивать гомогенизацию материала, полностью подавлять рост неспецифической гноеродной и гнилостной микрофлоры, которая может находиться в исследуемом материале, и максимально сохранять жизнеспособность присутствующих в материале микобактерии. Перед посевом исследуемый материал нужно сконцентрировать и освободить от сопутствующей гноеродной микрофлоры. Для этого мокроту, экссудаты и другой материал помещают в стерильную склянку с бусами или битым стеклом и обрабатывают щелочью или кислотой. Жидкие материалы предварительно центрифугируют, и дальнейшей обработке подвергают только осадок. В настоящее время для обработки патологического материала применяют следующие методы и детергенты.
1. Метод Гона — обработка растворами серной кислоты (2—6%) в зависимости от характера материала и степени его загрязненности неспецифической микрофлорой с последующим центрифугированием и отмыванием.
2. Метод Петрова — обработка 4% раствором NaOH с последующим центрифугированием и нейтрализацией осадка перед посевом; этот метод удобно использовать при одновременной обработке большого количества посевов. Щелочь растворяет белковые частицы, что способствует быстрой гомогенизации мокроты и других материалов, содержащих гной и слизь, и высвобождению из этих белковых частиц микобактерии туберкулеза.
3. Обработка 3% раствором серной кислоты в течение 20 мин (10 мин в спокойном состоянии, 10 мин при центрифугировании) с последующим 3-кратным отмыванием осадка стерильным изотоническим раствором.
4. Обработка 1% раствором серной кислоты после тщательной гомогенизации в течение 18—20 ч при комнатной температуре (метод Б. Я. Циммер).
5. Обработка 10% раствором трехзамещенного фосфата натрия. Это широко распространенный в нашей стране метод, допускающий длительную экспозицию материала с фосфатом натрия без нарушения жизнеспособности микобактерии, что особенно ценно в тех случаях, когда доставка материала затруднена. Трехзамещенный фосфат натрия хорошо угнетает сопутствующую флору и даже при 2—3-дневном хранении материала не повреждает микобактерии и мало влияет на их способность к росту на питательных средах.
Метод можно применять в двух модификациях: с нейтрализацией материала или без нейтрализации. В последнем случае к осадку после центрифугирования добавляют 1 мл жидкой среды Школьни-
ковои и полученную смесь полностью засевают на питательные среды.
6. При посеве сильно загрязненного материала используют более концентрированные растворы серной кислоты (5%).
Следует отметить, что поиски веществ, подходящих для обработки материала перед посевом, ведутся постоянно. Так, несколько лет назад было закончено коллективное исследование стран СЭВ по сравнительному испытанию подобных веществ. В качестве детергентов испытывались различные соединения: лауросепт X, некал ВХ, лаурилсульфат, хлоргексидин биглюконат и др. Оптимальные результаты были получены при применении лауросепта, который повысил на 16 % частоту выделения микобактерии туберкулеза. Однако отсутствие этого детергента ограничивает возможности его широкого применения на практике.
Для культивирования микобактерии туберкулеза используют различные питательные среды: плотные, полужидкие, жидкие (синтетические и полусинтетические). Однако ни одна из них не обладает качествами, предъявляемыми к ним современной бактериологической диагностикой туберкулеза. В связи с этим для повышения результативности культурального метода рекомендуется применять посев патологического материала одновременно на несколько (2—3) питательных сред. Для выделения чистых культур микобактерии туберкулеза чаще всего применяют различные по составу плотные питательные среды. В качестве стандартной среды для первичного выделения возбудителя и определения его лекарственной чувствительности ВОЗ рекомендована среда Левенштейна — Йенсена. Это плотная яичная среда, на которой хороший рост микобактерии туберкулеза получают на 15—25-й день после посева бактериоско-пически положительного материала.
В последние годы широкое распространение в нашей стране получила яичная среда II, предложенная Э. Р. Финном (среда Фин-на-П), Она отличается от среды Левенштейна — Йенсена тем, что вместо L-аспарагина в ней используется глутамат натрия. На этой среде рост микобайтерий туберкулеза появляется на несколько дней раньше, чем на среде Левенштейна — Йенсена. Процент выделения культур на этой среде на 6—8% выше, чем на среде Левенштейна —
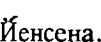
Для повышения вероятности получения роста микобактерии рекомендуется засевать патологический материал на 2—3 различные по составу питательные среды одновременно. В настоящее время, кроме безаспарагиновой среды Финна-И, в практику внедряется еще одна безаспарагиновая среда, разработанная В. А. Аникиным. По данным Московского НИИ туберкулеза, применение сред, сбалан-сирбванных по солевому составу и источникам азотистого питания иначе, чем среда Левенштейна — Йенсена, культуральная диагностика туберкулеза улучшается в среднем на 6,7%. Это особенно важно при таких формах туберкулеза, при которых возбудитель паразитирует в условиях ацидоза и анаэробиоза, в частности, при туберкулезе мочеполовых органов.
Для повышения результативности культурального метода наряду с применением одновременно нескольких различных по составу питательных сред для посева рекомендуется повторное многократное исследование материала, так как в настоящее время отмечается состояние олигобациллярности у большинства больных даже со све-жевыявленными деструктивными поражениями в легких. Олигоба-циллярность проявляется не только малым количеством возбудителей в диагностическом материале, но и транзиторностью, эпизодичностью их выделения. Поэтому часто посев даже на 3 различные питательные среды не обеспечивает полной информации о состоянии бактериовыделения.
Для повышения информативности культурального метода практикуется повторное многократное исследование материала от больных. По данным Центрального НИИ туберкулеза, методика 3-кратного первичного комплексного исследования бактериоскопическими и культуральными методами у впервые выявленных больных деструктивным туберкулезом легких дает дополнительно 3,4% положительных результатов, а у больных хроническим деструктивным туберкулезом, лечившихся до поступления в стационар, — 5,8% по сравнению с данными одноразового исследования. Однако, по данным ряда авторов, и 3-кратные посевы недостаточны для выявления истинной картины бактериовыделения. Так, установлено, что при обследовании нелечившихся больных максимальный прирост информации о бактериовыделении можно получить при 6-кратных повторных посевах материала, при этом количество положительных результатов возрастает на 36—37% по сравнению с данными 3-кратного посева. У больных после 3-месячного лечения ценность многократного исследования патологического материала методом посева возрастает и при 6-кратном исследовании показатель прироста положительных результатов может достигать 70%, а после 6 мес лечения он возрастает до 82%.
Таким образом, кратность исследования и состав питательных сред имеют важное значение для культуральной диагностики туберкулеза.
В связи с тем что в процессе интенсивной химиотерапии происходит повреждение различных метаболических систем микробной клетки, ряд микроорганизмов в микобактериальной популяции утрачивает способность нормально развиваться на питательных средах. Отмечается снижение жизнеспособности микобактерии, что может проявляться отсутствием роста на общепринятых питательных средах, а также возникновением способности расти только на осмотически сбалансированных (полужидкие или даже жидкие) питательных средах. Так, по данным И. Р. До рожковой, в процессе интенсивной противотуберкулезной химиотерапии часть микобактериальной популяции, утрачивая способность расти на плотных питательных средах, в то же время приобретает свойство расти на полужидких питательных средах, образуя микроколонии в верхнем наиболее аэрируемом участке питательной среды. Эта потребность в повышенной аэрации четко проявляется также при культивировании микобактерии в жидких питательных средах с увеличенной аэрацией, которая достигается при культивировании посевов во вращающемся термостате (Н. М. Макаревич).
После посева и закрытия пробирок материал должен быть распределен по всей поверхности питательной среды, для этого пробирки наклоняют. Пробирки должны находиться в горизонтальном положении в течение 24—48 ч, после чего их следует перевести в вертикальное положение.
Посевы нужно просматривать еженедельно. При этом обязательно регистрируются параметры: а) появление роста — срок появления, начиная со дня посева; б) интенсивность роста — число колоний, этот показатель имеет большое диагностическое и прогностическое значение, особенно если посевы производятся в динамике; в) загрязнение посева посторонней микрофлорой или грибами; г) отсутствие роста.
При первичном посеве бактериоскопически отрицательного материала на плотные среды средняя продолжительность роста составляет 20—46 дней. Отдельные штаммы растут 60 и даже 90 дней. Это заставляет выдерживать посевы в термостате в течение 3 мес, еженедельно проверяя появление роста.
Обычно вирулентные культуры микобактерии туберкулеза растут на плотных питательных средах в виде R-форм колоний различной величины и вида. Колонии сухие, морщинистые, цвета слоновой кости, но в случае диссоциации могут встречаться и влажные, слегка пигментированные колонии, розовато-желтый пигмент которых резко отличается от оранжевого или желтого пигмента сапрофитных или атипичных микобактерии. Последние обычно растут в S-форме. Следует отметить, что на среде Финна-И колонии микобактерии туберкулеза могут быть более влажными.
После курса химиотерапии от больных туберкулезом могут выделяться гладкие колонии с влажным ростом (S-формы). Гладкие колонии характерны также для Mycobacterium bovis, которые также патогенны для человека.
Положительный ответ дают только после микроскопии мазка из выросших колоний, окрашенного по Цилю — Нильсену. В мазках обнаруживаются ярко- и темно-красные палочки, лежащие одиночно или группами, образующие переплетения в виде «войлока» или «кос», часто видны темные зерна, особенно в длительно растущих культурах. В молодых культурах микобактерии туберкулеза (особенно выделенные от больных, длительно леченных химиопрепара-тами) часто отличаются большим полиморфизмом, вплоть до появления коротких, почти кокковидных форм.
Интенсивность роста обозначают по 4-балльной системе: + единичные колонии; ++ от 20 до 100 колоний; +++ от 100 до 200 колоний; мм несосчитываемое число колоний (сливной рост). В двух последних случаях имеется обильное бактериовыделение, которое является показателем активности процесса и/или неэффективности лечения.
Если морфология колоний или палочек вызывает сомнения в их туберкулезной природе или культуры выделены из материала, который может содержать кислотоустойчивые сапрофиты (моча, гной из ушей и др.), мазки дополнительно обесцвечивают спиртом (в течение 45—60 мин) или жавелевой водой (в течение 1—2 ч). Следует учитывать, что молодые культуры микобактерии туберкулеза могут обесцвечиваться спиртом и жавелевой водой, так как они еще слабо кислотоустойчивы. В таких случаях культуры следует выдержать еще несколько дней (5—10) в термостате и вновь повторить микроскопическое исследование, чтобы убедиться в их кислотоустойчивости.
Авирулентные сапрофитные и атипичные микобактерии обычно грубее, толще, иногда менее интенсивно окрашены и, как правило, не образуют жгутообразных сплетений (корд-фактор отсутствует). Однако некоторые виды атипичных микобактерии (фотохромоген-ные) могут расти в R-форме. Многие атипичные и сапрофитные микобактерии имеют кислотоустойчивые зерна, весьма сходные с таковыми у вирулентных микобактерии туберкулеза.
В тех случаях, когда выделяются культуры, вызывающие сомнения в плане их принадлежности к микобактериям туберкулеза, их изучают, используя комплекс специальных исследований, позволяющих дифференцировать типичные микобактерии туберкулеза от нетуберкулезных (атипичных) микобактерии и кислотоустойчивых сапрофитов.
Как отмечалось выше, в случае появления на питательных средах роста колоний и установления с помощью микроскопии окрашенных по Цилю — Нильсену мазков факта, что выросшая культура относится к кислотоустойчивым микобактериям, производится количественная оценка результатов посева. С этой целью применяют различные схемы оценки (одна из них приведена выше). В Центральном НИИ туберкулеза используют количественную оценку бактериовыделения методом посева по 3 степеням: 1) скудное — на плотных питательных средах вырастает 1—20 колоний во всех пробирках, использованных для данного посева; 2) умеренное — от 21 до 100 колоний во всех пробирках; 3) обильное — обнаруживается рост более 100 колоний во всех пробирках.
При лабораторной диагностике туберкулеза недостаточно дать ответ, констатирующий, обнаружены или нет тем или иным методом микобактерии туберкулеза. Для клиники туберкулеза, детального представления о характере микобактериальной популяции и определения прогноза заболевания необходимо изучение различных свойств культур, выделенных от больного: лекарственной чувствительности, ферментативной активности, вирулентности, видовой принадлежности. В некоторых случаях необходимо дифференцировать выделенные культуры и установить характер атипичных культур. Все это обусловливает то разнообразие исследований, которые необходимо проводить при лабораторной диагностике туберкулеза.
Определение лекарственной чувствительности выделенных штаммов микобактерии является необходимым и весьма важным этапом микробиологических исследований. Развитие лекарственной устойчивости обусловлено многими факторами: селекцией устойчивых вариантов в микобактериальной популяции, вегетирующей в организме больного; индукцией противотуберкулезными препаратами или антибиотиками, применяемыми в процессе химиотерапии; передачей эписомного R-фактора чувствительным особям (нехромосомная устойчивость) и др. Следует отметить, что снижение чувствительности микобактерии туберкулеза отмечается ко всем противотуберкулезным препаратам, однако оно может отличаться по степени, характеру, частоте и скорости появления. Известно, что из патологического материала от больных туберкулезом выделяются неоднородные по лекарственной чувствительности микобактерии: устойчивые к одному лекарственному препарату, или моноустойчивые, варианты с истинной двойной или полиустойчивостью, а также смесь вариантов, устойчивых к различным препаратам.
Дата добавления: 2015-04-25; просмотров: 1969;
