ПРОИЗВОДСТВО И ПРИМЕНЕНИЕ ФОРМАЛЬДЕГИДА
Формальдегид – бесцветный газ с резким удушливым запахом, ядовит. Он хорошо растворим в воде. Как и все летучие органические вещества, чистый формальдегид может находиться в одном из трех состояний – твердом, жидком или газообразном. Однако в этих состояниях формальдегид может присутствовать в виде целого ряда модификаций, различающихся и по химическим, и тем более по физическим свойствам
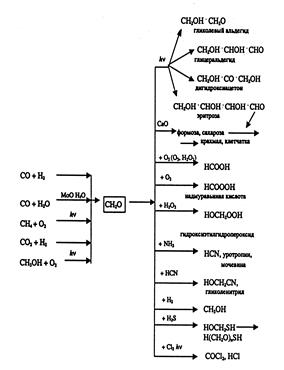
Схема простейших реакций образования и превращения формальдегида.
Большое значение имеет способность формальдегида реагировать с производными ароматических углеводородов и других соединений с образованием углеродного скелета, например:






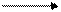 2R – + CH2O R – – CH2 – − R + H2O
2R – + CH2O R – – CH2 – − R + H2O
Методы получения формальдегида
Промышленные методы получения формальдегида большим разнообразием не отличаются. В реакциях восстановления оксида и диоксида углерода водой выход формальдегида очень мал. Внимание привлекала реакция гидрирования оксида углерода
 CO + H2 CH2O (1)
CO + H2 CH2O (1)
тем более, что эта реакция может рассматриваться как этап процесса получения метанола:
 CO + 2H2 CH3OН
CO + 2H2 CH3OН
Однако термодинамический расчет показывает, что равновесие реакции (1) сильно смещено влево. Даже при давлении 100 МПа равновесная концентрация формальдегида не достигает 2 %, а при 10 МПа и ниже измеряется сотыми и тысячными долями процента.
Сравнительно небольшую долю в общем балансе производства формальдегида занимают методы окисления природного газа и низших алканов из-за низкой селективности процесса. Предложения об использовании для получения формальдегида других видов сырья (диметиловый эфир, метилаль) развития не получили ввиду ограниченности сырьевой базы.
Основной промышленный метод получения формальдегида – каталитическое окислительное дегидрирование метанола:
 CH3OH + 0,5O2 CH2O + H2O
CH3OH + 0,5O2 CH2O + H2O
Окисление природного газа и низших парафинов.
 природный газ синтез-газ метанол формальдегид
природный газ синтез-газ метанол формальдегид
 | |||
 | |||
прямое окисление

Однако на практике получение формальдегида окислением метана сопряжено с целым рядом трудностей, важнейшие из которых связаны с недостаточной устойчивостью формальдегида в условиях реакции. В то же время термическое разложение формальдегида наблюдается уже при 400 оС. Образовавшийся формальдегид, кроме того, в присутствии кислорода подвергается дальнейшему окислению.
Превращение метана ускоряется при добавлении к исходной смеси продуктов окисления. Метанол и формальдегид образуются параллельно, а на следующих стадиях метанол превращается в формальдегид, а последний – в оксид углерода. Понижение температуры и повышение общего давления увеличивает выход метанола. В целом, при гомогенном газофазном окислении метана выход формальдегида за проход, как правило, не превышает 3 %, при селективности на уровне 10 – 25 %.
С целью интенсификации процесса окисления предложен целый ряд гетерогенных катализаторов. При 500 – 700 оС каталитическое действие проявляют алюмосиликаты и кварц, благодаря наличию геометрически и энергетически неоднородных участков поверхности либо кислотных центров. Реакцию можно проводить как в стационарном, так и в кипящем слое. Для повышения активности алюмосиликаты пропитывают растворами кислот, например фосфорной, борной.
Выход формальдегида несколько возрастает при замене воздуха чистым кислородом; одновременно увеличивается количество и других продуктов окисления. Доля формальдегида, образующегося при окислении бутана, несколько выше по сравнению с пропаном и изобутаном. Более высокая реакционная способность позволяет проводить реакцию при значительно более низких температурах, как правило, не выше 400 – 480 оС.
Окислительная конверсия метанола.
Получение формальдегида на металлических катализаторах.
Окислительная конверсия метанола в присутствии раскаленной меди (сетка, спирали, трубки) относится к числу старейших химических процессов. Смеси метанола с кислородом или с воздухом взрывоопасны. Окислительная конверсия метанола на серебре проводится при соотношении метанол: воздух выше верхнего предела взрываемости, то есть при большом избытке метанола по отношению к кислороду.
Реакция превращения метанола в формальдегид на представляется простой. Однако более детальные исследования показали, что брутто-процесс состоит из более чем десятка индивидуальных реакций. Образование формальдегида осуществляется в результате протекания параллельных реакций простого и окислительного дегидрирования метанола:
CH3OH 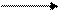 CH2O + H2 – 93,4 кДж/моль (2)
CH2O + H2 – 93,4 кДж/моль (2)
CH3OH + 0,5O2 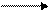 CH2O + H2O +147,4 кДж/моль (3)
CH2O + H2O +147,4 кДж/моль (3)
Наряду с этими реакциями в системе протекает целый комплекс побочных превращений.
Развитие каждой из этих реакций по-своему зависит от таких факторов, как наличие катализатора, температура, фазовое состояние и т. д. Ключевые превращения (2) и (3) осуществляются на поверхности катализатора. Первым актом этих реакций является адсорбция метанола на поверхности окисленного серебра. Превращение метанола в формальдегид происходит в результате контакта молекул спирта с кислородом, хемосорбированным на атомах серебра. Активными центрами катализатора являются поверхностные оксиды серебра. Однако взаимодействие кислорода с серебром не ограничивается одной адсорбцией. В поверхностных слоях серебра происходит растворение кислорода в металле, причем растворенный кислород, в свою очередь, оказывает влияние на дальнейшую адсорбцию кислорода из газовой фазы.
Побочные реакции окисления метанола и формальдегида до диоксида углерода и воды частично развиваются уже на поверхности серебра.
Из числа остальных побочных реакций следует выделить взаимодействие формальдегида с водой с образованием муравьиной кислоты.
На многих установках по получению формальдегида из метанола применяются трегерные серебряные контакты типа известного катализатора серебро на пемзе.
На большинстве зарубежных формалиновых производств используют металлическое серебро без носителя (сетки, кристаллы, губчатое серебро и т. д.).
По селективности образования формальдегида компактные (ненасенные) и трегерные (на носителе) катализаторы являются практически равноценными. Однако по конверсии метанола, а, следовательно, и по выходу формальдегида за проход серебряная сетка, обладающая минимальной удельной поверхностью, существенно уступает высокодисперсному электролитическому серебру и трегерному контакту.
Основные различия трегерных и компактных катализаторов относятся к их эксплуатационным характеристикам. К преимуществам трегерных контактов относятся следующие: а) устойчивость по отношению к перегревам; б) пониженная требовательность к чистоте сырья; в) длительность межрегенерационного цикла работы (год и более); г) меньшая единовременная загрузка серебра.
Использование ненанесенного (компактного) серебра имеет следующие достоинства: а) исключение комплекса вопросов, связанных с получением и подготовкой носителя; б) “безреагентная” система приготовления катализатора; в) практическое отсутствие потерь серебра за счет истирания и измельчения контакта.
Пемза представляет собой пористый вулканический продукт, который образовался при быстром охлаждении лав, сопровождавшимся интенсивным газовыделением. Ее усредненный химический массовый состав (в мас %): SiO2 67 – 70, Al2O3 14,0 – 17,0, Fe2O3 0,9 – 1,6, TiO2 0,13 – 0,24, MnO 0,06 – 0,09, MgO до 0,8, CaO 1,6 – 2,5, Na2O 3,0 – 4,1, K2O 3,0 – 3,9.
Носитель МАС (модифицированный синтетический алюмосиликат) специально разработан с целью замены пемзы, и по своим свойствам близок к ней.
Большое распространение приобрело модифицирование серебряного катализатора различными металлами и их оксидами - оксидами цинка, бериллия, циркония, сурьмы.
Получение формальдегида на оксидных катализаторах.
Каталитическая активность оксидов металлов (т. е. конверсия метанола) меняется в ряду MoO3 < TiO2 < Fe2O3 < Cr2O3 < NiO < V2O5 < Mn2O3 < CuO < Co3O4, а селективность по формальдегиду почти в обратной последовательности: Co3O4 < CuO < Fe2O3 < Mn2O3 < Cr2O3 < NiO < V2O5 < TiO2 < MoO3 .
На практике в качестве катализатора наибольшее распространение получила смесь оксидов железа (3) и молибдена (4) с атомным соотношением молибдена к железу от 1,7 до 2,5 Окисление метанола на оксидных катализаторах протекает по окислительно-восстановительному механизму, например:
CH3OH + 2MoO3 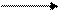 CH2O + H2O + Mo2O5
CH2O + H2O + Mo2O5
Mo2O5 + 0,5O2 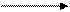 2MoO3
2MoO3
или
CH3OH + 0,5O2 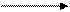 CH2O + H2O + 147,4 кДж
CH2O + H2O + 147,4 кДж
В основе превращения метанола на оксидном контакте, как и на серебре, лежит реакция окислительного дегидрирования метанола. По существу единственной побочной реакцией данного процесса является дальнейшее окисление образовавшегося формальдегида.
Лимитирующая стадия как основной, так и побочной реакции – взаимодействие метанола с поверхностным кислородом, собственно основной химический акт. Образующаяся вода оказывает тормозящее действие на обе реакции. Кроме того, метанол тормозит окисление формальдегида до оксида углерода и воды.
Оксидные катализаторы значительно менее чувствительны к примесям, чем серебряный и его аналоги.
Для поддержания активности катализатора реакцию необходимо проводить в избытке кислорода, поскольку в противном случае под действием метанола и формальдегида катализатор восстанавливается. Реакцию проводят при соотношении реагентов и воздуха ниже нижнего предела взрываемости, а именно, при содержании метанола в исходной смеси не выше 7 – 8 %. Рабочая температура процесса поддерживается на уровне 350 – 390 оС. Стабильность катализатора можно повысить путем применения различных добавок, например соединений хрома, олова. При использовании в качестве катализатора смеси оксидов олова и молибдена в атомном соотношении 7 : 3 и 160 оС мольная селективность достигает 90 %, при конверсии метанола 72 %.
Если порядка 80% формальдегида получают в промышленности на серебряном катализаторе по технологии, разработанной фирмой “BASF”, то остальная часть формальдегида производится с помощью процесса FORMOX в присутствии железомолибденового катализатора при 300оС и атмосферном давлении. В этом процессе степень превращения метанола составляет 99% при селективности 97%.
Получение формальдегида дегидрированием метанола.
Разработан процесс дегидрирования метанола на медьцинкселеновом катализаторе при 600 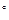 С в присутствии воздуха. В этом процессе формальдегид образуется с селективностью 92% при степени превращения метанола 60%, которая ограничивается термодинамикой процесса:
С в присутствии воздуха. В этом процессе формальдегид образуется с селективностью 92% при степени превращения метанола 60%, которая ограничивается термодинамикой процесса:
 СН3ОН Н2СО + Н2
СН3ОН Н2СО + Н2
Процесс дегидрирования метанола пока не реализован в промышленности, однако он является очень перспективным, так как позволяет получать не содержащий воды формальдегид и ценный газ - водород, а также учитывая то, что в будущем образующуюся в процессе метанолформальдегидную смесь можно перерабатывать без разделения. Поэтому в настоящее время интенсивно ведутся научные исследования по поиску эффективных каталитических систем для этого процесса.
Дата добавления: 2015-04-15; просмотров: 5921;
