РАЦИОНАЛЬНЫЕ ПАРАМЕТРЫ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ
Рациональная методика ИВЛ может сделать ее высокоэффективной и в то же время практически безопасной, если она основана на обеспечении адекватного газообмена при максимальном ограничении вредных эффектов, а также при сохранении субъективного ощущения «дыхательного комфорта» у больного, если он во время ИВЛ остается в сознании.
Понятие «рациональная методика» подразумевает прежде всего рациональный выбор для данного больного следующих параметров ИВЛ: минутной вентиляции, дыхательного объема, частоты вентиляции, давления на вдохе и на выдохе (а также особенностей его изменения в течение дыхательного цикла), отношения продолжительности вдоха и выдоха, скорости вдувания газов (а также особенностей ее изменения в течение дыхательного цикла).
Указанные параметры тесно связаны и обусловливают друг друга. Тем не менее при выборе конкретных величин параметров ИВЛ одному из них придается значение основного, определяющего величину всех остальных. Таким основным параметром является минутный объем вентиляции.
Минутный объем вентиляции. ИВЛ только тогда выполнит свое назначение, когда обеспечит достаточный минутный объем альвеолярной вентиляции, какими бы при этом ни оказались другие параметры.
При ИВЛ достаточную вентиляции можно определить как обмен вентиляционных объемов между внешней средой и легкими, необходимый для поддержания нормального напряжения углекислого газа в артериальной крови. Величина достаточной вентиляции зависит от величины общего мертвого пространства (к которой следует прибавить также и величину «мертвого пространства аппарата»), а также от количества углекислого газа, выделяемого в организме больного.
Как указывалось выше, величиной, характеризующей легочную вентиляцию, является не минутный объем дыхания, а минутный объем альвеолярной вентиляции, который равен разности дыхательного объема и общего объема мертвого пространства, умноженной на частоту дыхания. При этом выбираемыми для ИВЛ параметрами являются дыхательный объем и частота дыхания.
Дыхательный объем. Он должен быть достаточным для «промывки» мертвого пространства и удаления углекислого газа из альвеолярного воздуха. Если дыхательный объем будет меньше или равен объему мертвого пространства, то теоретически альвеолярная вентиляция должна быть равна нулю. Однако практически при дыхательном объеме, который меньше объема мертвого пространства, незначительное количество вдыхаемого газа все же достигает альвеол [Briscoe et al., 1951]. Это происходит главным образом в результате конического (слойного) движения вдыхаемого газа по воздухоносным путям и диффузии газа в газовой среде.
Для здорового человека размеры физиологического мертвого пространства и количество выделяемого углекислого газа могут быть высчитаны с достаточной точностью, что позволило Radford и соавт. (1954, 1955) предложить способ определения необходимого объема вентиляции.
С учетом объема мертвого пространства и необходимой минутной вентиляции Radford и соавт. составили номограмму для определения оптимального дыхательного объема, обусловленного полом и массой тела пациента, частотой дыхания и температурой тела (рис. 3).
Номограмма Рэдфорда составлена для определения оптимального дыхательного объема в обычных условиях основного обмена. Условия при наркозе или проведении реанимационных мероприятий значительно отличаются от условий основного обмена. Поэтому в найденную по номограмме величину оптимального дыхательного объема вводят поправки с учетом ряда факторов:
1) при повышенной температуре тела необходимый дыхательный объем увеличивают на 5% на каждые 0,5°С сверх 37°С;
2) при «обычной активности» увеличивают дыхательный объем на 10% по сравнению с таковым в условиях основного обмена;
3) в местностях выше уровня моря дыхательный объем увеличивают на 5% на каждые 600 м;
4) при применении медикаментов, обладающих катаболическим действием (например, атропин, этиловый эфир), увеличивают дыхательный объем в среднем на 20%;
5) при ИВЛ через трахеальную трубку (или трахеостомическую канюлю) дыхательный объем уменьшают на 30 — 50 мл, так как трахеальная интубация (или трахеостомия) уменьшает мертвое пространство;
6) объем присоединительных частей аппарата (маска, тройник, коннектор и т.д.) прибавляют к дыхательному объему, найденному по номограмме Рэдфорда;
7) повышенное давление в аппарате во время фазы вдоха приводит к некоторому растяжению обычных гофрированных шлангов на всем пути газовой смеси от аппарата до тройника. На заполнение возросшего объема шлангов уходит некоторая часть подаваемого дыхательного объема; ее величина зависит от растяжимости шлангов и давления во время дыхательного цикла. С учетом этого фактора корригируют подаваемый аппаратом дыхательный объем. Значимость этого фактора особенно возрастает при высокочастотной ИВЛ с относительно малым дыхательным объемом и высокой величиной ПДКВ.
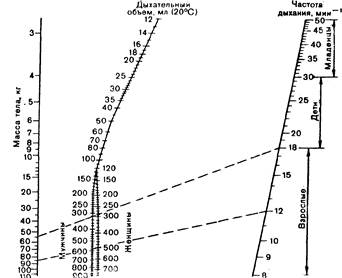
3, Номограмма для определения оптимального дыхательного объема [по Radford et al., 1954].
Практически при определении оптимального дыхательного объема для ИВЛ нужно учитывать сумму перечисленных факторов. Кроме того, при ИВЛ могут, быть регионарные нарушения вентиляционно-перфузионных отношений с увеличением доли альвеолярного мертвого пространства, что само по себе требует увеличения, нередко значительного, объема вентиляции. Поэтому при ИВЛ величину дыхательного объема, найденную по номограмме Рэдфорда, увеличивают в среднем на 30%. Т.М. Дарбинян (1976) предложил следующую формулу для расчета минутного объема вентиляции:
MOB (л/мин) = масса_тела/10 кг + 1.
В.С. Ширяев и А.Л. Тверской (1979) подтвердили приемлемость этой формулы.
Не следует забывать о возможной утечке вдыхаемого газа на пути от аппарата до легких пациента. Утечка бывает непредвиденной (из-за плохой герметизации системы) или преднамеренной (открытие предохранительного клапана). Всякая утечка газа должна быть вовремя обнаружена, устранена или учтена при подаче необходимого дыхательного объема.
Для контроля адекватности вентиляции наряду с измерением напряжения углекислого газа в крови необходимо измерять минутную вентиляцию и дыхательный объем. Достоверные данные позволяет получить только непосредственное измерение дыхательного объема с помощью специальных приборов (вентилометр, спиромонитор). Для большей точности измерений приборы или их датчики устанавливают в линии выдоха.
Одновременно с измерением дыхательного объема необходимо измерять максимальное давление вдоха с помощью мановакуумметра, который есть у аппаратов ИВЛ практически всех типов. Измерение давления на вдохе позволяет (при известном дыхательном объеме) весьма приблизительно вычислить растяжимость легких и грудной клетки (как отношение величины дыхательного объема к величине давления вдоха). Уменьшение растяжимости имеет важное прогностическое значение прежде всего как ранний признак легочных осложнений с нарушением вентиляционно-перфузиоииых отношений. Кроме того, если применяется аппарат ИВЛ с переключением по давлению, то нераспознанное уменьшение растяжимости легких и грудной клетки неизбежно приведет к уменьшению дыхательного объема со всеми нежелательными последствиями.
Частота дыхания. Не менее важно рационально выбрать частоту дыхания. Многие авторы считают оптимальной частоту 14 — 18 в минуту при ИВЛ у взрослых [Максимов Б.П., 1979; Herzog, 1970; Bergman, 1972]. Вполне допустимы колебания частоты от 10 — 12 [Афинский Н.П., 1972; Pontoppidan, 1965] до 20 — 22 в минуту [Кассиль В.Л., Рябова Н.М., 1977].
Слишком редкое дыхание нерационально, так как при нем значительно возрастает необходимый дыхательный объем, что может привести к чрезмерно высокому и опасному «пику давления», к перерастяжению стенок альвеол и баротравме легких. Кроме того, слишком редкое дыхание с большими экспираторными паузами может вызвать так называемую циклическую гипоксемию [Bergman, 1961].
При более частом дыхании можно подобрать такой дыхательный объем, чтобы альвеолярная вентиляция оставалась нормальной. Так, Gray и соавт. (1959) для максимального уменьшения «пика давления» в альвеолах и среднего внутригрудного давления первыми предложили применять частое дыхание (до 50 — 60 в минуту) при снижении дыхательного объема до 250 мл.
Недостаточная и избыточная вентиляция. Что же является показателем достаточности вентиляции: нормальное содержание О2 или СО2 в крови, оттекающей от легкого?
Насыщение крови кислородом зависит не только от величины вентиляции, но и от распределения вентиляции и кровотока, существования артериовенозных шунтов, диффузионной способности альвеоло-капиллярных мембран, а при вдыхании газовой смеси — еще и от содержания в ней кислорода. В то же время удаление углекислого газа зависит практически только от альвеолярной вентиляции. Легко представить случай, когда вследствие значительного нарушения диффузии кровь легочных капилляров не будет достаточно насыщена кислородом (если во вдыхаемой смеси газов парциальное давление кислорода не будет повышенным), какой бы величины ни достигла вентиляция, в то время как содержание углекислого газа в крови легочных капилляров будет нормальным. При значительном уменьшении дыхательного объема, по высоком содержании кислорода во вдыхаемой газовой смеси гииоксемии может и не быть, но обязательно наступят задержка углекислого газа и гиперкапния.
Таким образом, достаточность минутного объема вентиляции определяется нормальным содержанием углекислого газа в крови, оттекающей от легкого. В свою очередь содержание углекислого газа в артериальной крови может быть определено по его содержанию в альвеолярном воздухе, которое в норме составляет приблизительно 5,6% (РАсо2 соответственно равно 40 мм рт. ст). Следовательно, можно заключить, что при нормально функционирующих легких достаточным будет тот объем вентиляции, при котором содержание СО2 в альвеолярном воздухе составит приблизительно 5,6%.
Гиповентиляция во время ИВЛ, когда больному подают смесь газов с повышенным содержанием кислорода, редко приводит к гипоксемии, но всегда вызывает задержку и накопление углекислого газа в альвеолярном воздухе и в крови, т.е. гипоркапнию.
Однако ИВЛ нередко сопровождается не гипо-, а гипервентиляцией, результатом которой становится гипокапния. Умеренная альвеолярная гипервентиляция (при напряжении CO2 в артериальной крови, равном 30 — 35 мм рт. ст.) почти никогда не является опасной. «Неинструментальная» диагностика гипер-, а особенно гипокапнии во время ИВЛ трудна и требует опыта и наблюдательности. Наиболее надежные результаты дает измерение напряжения углекислого газа в артериальной крови. Можно также измерить содержание углекислого газа в альвеолярном воздухе. Следует помнить, что концентрации (напряжение) альвеолярного и артериального CO2 могут считаться равными только у больных с нормальной функцией легких. При выраженных расстройствах отношения вентиляция/перфузия альвеолоартериальный градиент СО2 неопределенно увеличен и непостоянен, да и сам анализируемый в этих случаях газ представляет собой не альвеолярный, а так называемый конечно-выдыхаемый газ (end-expiration gas английских авторов).
На практике важно знать, как быстро меняется концентрация CO2 в альвеолярном воздухе при тех или иных изменениях вентиляции. Допустим, что врач обнаружил у пациента признаки, гиперкапнии. Сколько времени нужно проводить гипервентиляцию, чтобы удалить избыток СО2 из альвеол? Dripps, Severinghaus (1955), ссылаясь на опыты Fenn, Rahn, Utis, утверждают, что требуется не менее 4 мин интенсивной гинервентиляции, чтобы получить стойое снижение альвеолярной концентрации СО2 на 50% от исходного уровня. Таким образом, если в результате гиповентиляции РАсо2 поднялось с 40 до 80 мм рт. ст., то потребуется не менее 4 мин гипервентиляции, чтобы нормализовать содержание СО2 в альвеолах. Разумеется, что при большем накоплении углекислого газа нужна еще более длительная гипервентиляция. Все указанное верно и тогда, когда у пациента имеется не гипер-, а гипокапния в результате гипервентиляции и когда необходимо поднять содержание СО2 до нормальных цифр. Конечно, и в этом случае нужна довольно длительная нормальная или пониженная (допустима только при высоком содержании кислорода во вдыхаемой смеси газов) вентиляция, чтобы вернуть содержание СО2 в альвеолах к нормальным цифрам.
Отметим, что для изменения концентрации альвеолярного кислорода нужно гораздо меньше времени: достаточно, например, нескольких глубоких вдохов газовой смеси с высоким содержанием кислорода, чтобы вывести больного из состояния дыхательной гипоксии. Разница связана с тем, что емкость крови и тканей для углекислоты гораздо выше, чем для кислорода.
Снижение максимального и среднего давлений в легких.Мы отмечали уже, что больному при всех условиях должен быть обеспечен достаточный минутный объем вентиляции. Однако совершенно не безразлично, ценой какого давления в легких будет достигнут этот объем вентиляции. Как показали ставшие классическими исследования, вредные эффекты ИВЛ связаны прежде всего с повышением среднего виутрилегочного давления. Поэтому долго считали рациональной такую методику ИВЛ, при которой дыхательные потребности пациента удовлетворяются при наиболее низком среднем давлении в легких.
Считалось общепринятым, что «пик давления» в легких на высоте вдоха не должен превышать 20 см вод.ст., и лишь во время коротких периодов раздувания легких допустимо давление, превышающее 30 см вод.ст. Желательно, чтобы среднее внутрилегочное давление не превышало 4 — 5 см вод.ст. Со времен исследований Frey, Stoffregen (1959) оптимальным считался такой режим ИВЛ, при котором среднее внутрилегочное давление стремится к нулю, как при спонтанном дыхании.
Дыхательные потребности больного во время ИВЛ при минимальном среднем давлении в легких можно обеспечить при соблюдении следующих условий.
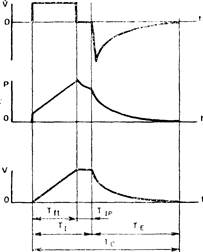
1. Положительное давление в легких должно поддерживаться только во время введения в легкие требуемого дыхательного объема. Иными словами, выдох должен начинаться немедленно после введения газа в легкие, без задержки после вдоха. Задержка газа в легких после окончания вдувания (пауза вдоха), как при использовании некоторых моделей аппаратов ИВЛ, приводит к появлению «плато» на кривой давления и к увеличению среднего внутрилегочного давления.
Паузой вдоха следует называть ту часть вдоха, во время которой вдувание газа в легкие пациента уже прекратилось, а выдох еще не начался. С технической точки зрения пауза вдоха характеризуется тем, что линии вдоха и выдоха аппарата перекрыты и от пациента отсоединены, поэтому скорость вдувания равна нулю, а давление «во рту» и дыхательный объем не увеличиваются (рис. 4). Ряд авторов, начиная с Engstrorn (1963), считают, что наличие «плато» способствует равномерности внутрилегочного распределения вентиляции [Максимов Б.П., 1979; Damman, McAslan, 1977; Zietz, 1981]. Вместе с тем специальные клинические исследования с применением азотографического метода определения равномерности вентиляции [Юревич В.М., 1966], равно как и экспериментальные исследования на модели легких [Черкасова А.А., 1970], не выявили отличий в равномерности распределения вентиляции при проведении ИВЛ с «плато» на вдохе и без него. Nordstrom (1972) в весьма обстоятельных экспериментальных исследованиях обнаружил, что Pao2 и Расо2 не имеют различий при ИВЛ с «плато» на вдохе и без него. Зато при наличии «плато» на вдохе было отмечено уменьшение минутного и ударного объема сердца, снижение артериального давления, а также снижение проходимости сосудов легкого (что эквивалентно уменьшению легочного кровотока). Клинические исследования Б.П. Максимова (1979) также показали, что введение паузы вдоха, составляющей по времени 20% от длительности всего дыхательного цикла, приводит к повышению среднего внутрилегочного давления на 43% и сопровождается снижением венозного возврата крови и производительности работы сердца.
|
4. Функциональные кривые объемной скорости (V), давления (Р) и объема (V) при ИВЛ с паузой вдоха:
Тff, — продолжительность вдуоания;
TI — продолжительность вдоха:
ТE — продолжительность выдоха:
TC — продолжительность дыхательного цикла;
ТIP — продолжительность паузы вдоха.
Представляет несомненный интерес рассмотреть процессы, происходящие в легких при наличии или отсутствии паузы вдоха с использованием математической двухкамерной модели легких. Характеристиками модели служат общие значения растяжимости (Со) и сопротивления (Ro), a также регионарные значения этих параметров: для левой камеры Ci и Ri, для правой камеры Са и R2.
Методика нашего исследования заключалась в расчете и сопоставлении объемов газа (V1, V2), поданных в каждую камеру, и возникающих там давлений P1, Р2 (для модели в целом — V0 и Р0). При этом рассмотрены два режима ИВЛ: с паузой на вдохе и без паузы, обеспечивающих одну и ту же вентиляцию. Кроме того, исследования основывались на том, что давления на входе в каждую камеру равны между собой, а объемная скорость вдувания в модель равна сумме объемных скоростей вдувания газа в каждую из камер:
V0 = V1 + V2.
Чтобы приблизить результаты расчетов к реальной клинической ситуации, они были выполнены для следующих пяти комбинаций характеристик камер модели:
модель 1 — в целом имеет типовое значение растяжимости и несколько увеличенное (для получения контрастных результатов) значение сопротивления. Характеристики каждой камеры одинаковы, что соответствует отсутствию легочной патологии;
модель 2 — при прежних значениях характеристик модели в целом моделируется рестриктивно-обструктивная патология в левой камере: снижается ее растяжимость и одновременно увеличивается сопротивление. Изменения характеристик подобраны так, чтобы постоянные времени камер (тау=RC) сохранили прежнее и равное предыдущей ситуации значение;
модель 3 — сохраняя неизменными значения характеристик модели в целом, моделируется маловероятная ситуация, при которой снижение растяжимости в левой камере сопровождается уменьшением ее сопротивления; в правой камере характеристики изменяются в обратном направлении. Существенная особенность этого случая — резкое различие (в 16 раз) постоянной времени камер;
модель 4 — рестриктивная патология: растяжимость левой камеры по сравнению с правой снижается, но сопротивления камер остаются равными между собой и соответствующими первой ситуации. Общие характеристики модели остаются теми же, что и в других ситуациях;
модель 5 — обструктивная патология в правой камере:
при нормальных и одинаковых значениях растяжимости сопротивление правой камеры значительно увеличивается. Общие характеристики модели остаются неизменными.
Количественные значения параметров камер, принятые в расчетах, приведены в табл. 2.
Таблица 2
Величины функциональных параметров для исследуемых моделей «легочной патологии»
| Параметр | Значение параметров для моделей | ||||
| Растяжимость, л/кПа: | |||||
| левая камера, C1 | 0,25 | 0,10 | 0,10 | 0,10 | 0,25 |
| правая камера, С2 | 0,25 | 0,40 | 0,40 | 0,40 | 0,25 |
| общая, С0 | 0,50 | 0,50 | 0,50 | 0,50 | 0,50 |
| Сопротивление, - кПа x с/ л | |||||
| левая камера, R1 | 0,80 | 2,00 | 0,50 | 0,80 | 0,50 |
| правая камера, R2 | 0,80 | 0,50 | 2,00 | 0,80 | 2,00 |
| общее, R0 | 0,40 | 0,40 | 0,40 | 0,40 | 0,40 |
| Постоянная времени, с: | |||||
| левая камера, t1 | 0,20 | 0,20 | 0,05 | 0,08 | 0,125 |
| правая камера, Т2 | 0,20 | 0,20 | 0,80 | 0,32 | 0,50 |
| общая, т0 | 0,20 | 0,20 | 0,20 | 0,20 | 0,20 |
Результаты расчета приведены в табл. 3. Для режима ИВЛ с паузой вдоха после ее возникновения давления выравниваются: газ из камеры с большим давлением перетекает в камеру с меньшим давлением. Давления выравниваются только в тех случаях, когда в конце вдувания давления в левой и правой камерах неравны, т.е. в моделях 3, 4 и 5. Конечным результатом этого процесса должно быть установление в каждой камере общего значения, равного Р0 = S/V, т.е. 1,6 кПа. Однако для такого выравнивания требуется некоторое время. Для принятой двухкамерной модели постоянная времени выравнивания имеет вид:
Tв=C1C2 (R1 + R2)/(C1 + С2)
Как известно, для завершения экспоненциального процесса выравнивания на 95% требуется интервал, равный трем постоянным времени выравнивания, т.е. для модели 3 — 0,6 с, для модели 4 — 0,38 с и для модели 5 — 0,94 с. Отсюда ясно, что процесс выравнивания давления в камерах модели при принятом значении длительности паузы вдоха 0,3 с полностью завершиться не успеет. Поэтому давления в камерах в конце паузы хотя и несколько сблизятся, но все же будут различными. Естественно, что и объем в этих камерах в конце паузы также не будет равным (см. табл. 2, значение для моделей 3, 4 и 5).
Результаты расчетов показывают, что при одинаковых характеристиках камер (модель 1) объемы и давления в них будут равными. В этом случае введение паузы вдоха оказывается безрезультатным.
При рестриктивно-обструктивной патологии в одной из камер (модель 2) изменения растяжимости и сопротивления таковы, что их влияния на постоянную времени камеры имеют тенденцию к взаимной компенсации: снижение растяжимости уменьшает, а рост сопротивления увеличивает постоянную времени камеры. Если комбинация этих факторов приводит к равенству постоянных времени обеих камер, как в данном случае, то давление в конце вдувания в них становится одинаковым и не требует выравнивания. Однако объемы вентиляции камер не равны между собой и прямо пропорциональны их растяжимости. Отсутствие выравнивания давления отнюдь не означает равномерного внутрилегочного распределения объемов, но делает бесполезным применение паузы вдоха.
В модели 3 рестриктивно-обструктивная патология такова, что сопровождается неравенством постоянных времени камер. В конце вдувания объемы и давления в камерах различны. Поэтому при ИВЛ с паузой вдоха происходит выравнивание давления, которое, однако, за длительностью паузы при использованных в расчете значениях параметров завершается лишь на 78%. Так как в конце вдувания большее давление было создано в камере, в которую был введен меньший объем, то происходит парадоксальное явление: выравнивание давления сопровождается углублением неравенства распределения объемов. Поэтому ИВЛ без паузы на вдохе, с точки зрения равномерности вентиляции, более благоприятна, поскольку высокое сопротивление «сдерживает» поступление газа в камеру с большей растяжимостью.
| Показатель вентиляции | Модель 1 | Модель 2 | Модель 3 | Модель 4 | Модель 5 | ||||||||||
| левая камера | правая камера | модель в целом | левая камера | правая камера | модель в целом | левая камера | правая камера | модель в целом | левая камера | правая камера | модель в целом | левая камера | правая камера | модель в целом | |
| Показатели вентиляции в конце вдувания: | |||||||||||||||
| Скорость вдувания, V, л/с: | |||||||||||||||
| без паузы вдоха | 0,400 | 0.400 | 0,800 | 0,160 | 0,640 | 0,800 | 0,240 | 0,560 | 0,800 | 0,187 | 0,613 | 0,800 | 0.457 | 0,343 | 0,800 |
| с паузой вдоха | 0.570 | 0,570 | 1,140 | 0,228 | 0,912 | 0,140 | 0,380 | 0,760 | 1,140 | 0,281 | 0,859 | 1,140 | 0,676 | 0.464 | 1,140 |
| Дыхательный объем, V, л: | |||||||||||||||
| без паузы вдоха | 0,400 | 0,400 | 0,800 | 0,160 | 0,640 | 0,800 | 0,240 | 0,560 | 0,800 | 0,187 | 0,613 | 0,800 | 0,457 | 0,343 | 0,800 |
| с паузой вдоха | 0,400 | 0,400 | 0,800 | 0,160 | 0,640 | 0,800 | 0,267 | 0,532 | 0,800 | 0,198 | 0,602 | 0,800 | 0,474 | 0,326 | 0,800 |
| Давление в камере, Р, кПа: | |||||||||||||||
| без паузы вдоха | 1,60 | 1,60 | — | 1,60 | 1,60 | — | 2,40 | 1,40 | — | 1.87 | 1,53 | — | 1,83 | 1,37 | — |
| с паузой вдоха | 1,60 | 1,60 | — | 1,60 | 1,60 | — | 2,66 | 1,33 | — | 1,97 | 1,51 | — | 1,89 | 1,29 | — |
| Давление на входе в модель, Ро, кПа | |||||||||||||||
| без паузы вдоха | — | — | 1,92 | — | — | 1,92 | о ко | 2,02 | 2,06 | ||||||
| с паузой вдоха | — | — — | 2,06 | — — | — | 2,06 | — | — | 2,85 | — | — | 2,19 | — | — | 2,23 |
| Показатели вентиляции в конце паузи вдоха: | |||||||||||||||
| Давление в камере Рп, кПа | Вследствие равенства давлений в камерах в конце вдувания перераспределение давлении и объемов в камерах не происходит | 1,837 | 1,540 | — | 1,636 | 1,591 | — | 1,710 | 1,470 | — | |||||
| Дыхательный объем в камере, Vп, л | 0,186 | 0,614 | 0,800 | 0,165 | 0,635 | 0,800 | 0,428 | 0,372 | 0,800 | ||||||
| Давление на входе в модель, Роп, кПа | — | — | 1,780 | — | — | 1.610 | — | — | 1,660 |
В модели 4 при моделировании рестриктивной патологии сравнительно небольшая разница давлений в камерах за время паузы при ИВЛ почти полностью нивелируется. Однако и в этом случае нельзя говорить о положительном влиянии паузы на равномерность вентиляции, поскольку выравнивание давления, как и в модели 3, сопровождается перетеканием газа из камеры с меньшим объемом в камеру с большим объемом, т.е. дифференциация объемов в камерах по сравнению с ИВЛ без паузы вдоха только усиливается.
Наконец, в модели 5 (обструктивная патология) равенство растяжимостей камер приводит к тому, что выравнивание давлений одновременно означает и выравнивание объемов. Однако для полного выравнивания может потребоваться столь длительная пауза, которая практически неосуществима. При использованных в расчете значениях за паузу, равную 0,3 с, выравнивание давлений обеспечивается на 62%, по и при этом ИВЛ с паузой вдоха лишь незначительно уменьшает разницу в объемах камер по сравнению с ИВЛ без паузы вдоха.
Если в качестве критерия равномерности внутрилегочного распределения вентиляции принять выравнивание объема и давления газа в участках легких с различными комбинациями растяжимости и сопротивления, то использованная методика не выявляет заметных преимуществ ИВЛ с паузой вдоха. Действительно, хотя пауза вдоха стимулирует выравнивание давлений в различных частях легких, однако за реально применяемое время паузы полного выравнивания не происходит; выравнивание давления в общем случае не только не равнозначно выравниванию объемов, но в ряде ситуаций приводит к дальнейшему увеличению неравномерности распределения объемов; некоторое незначительное преимущество ИВЛ с паузой вдоха проявляется только в случае обструктивной патологии частей легких.
Приведенные выводы не исключают целесообразности применения паузы вдоха. Следует, вероятно, согласиться с мнением Loh, Sykes (1978), которые считают возможности использования и регулирования по времени паузы в конце вдоха не обязательными, но желательными для универсальных аппаратов ИВЛ.
2. Скорость вдувания газовой смеси в легкие должна быть оптимальной. Чем выше скорость вдувания при заданном дыхательном объеме, тем меньше будет время вдоха, а следовательно, тем ниже будет среднее внутрилегочное давление.
Скорость вдоха зависит от величины дыхательного объема и частоты дыхания. Кроме того, на величину скорости потока газа при вдохе оказывает решающее влияние отношение длительности вдоха к длительности выдоха. Если, например, дыхательный объем равен 500 мл, частота дыхания 20 в минуту, а отношение длительности вдоха к длительности выдоха 1:2, то продолжительность одного дыхательного цикла 3 с, время вдоха 1 с, а скорость вдувания 500 мл/с, или 30 л/мин. При заданных дыхательном объеме и частоте дыхания изменить скорость вдувания можно изменением отношения длительности вдоха и выдоха.
С позиции уменьшения среднего внутрилегочного давления и тем самым уменьшения отрицательного влияния ИВЛ на гемодинамику можно было бы считать, что чем выше скорость вдоха, тем лучше. Однако многочисленные исследования показали, что высокая скорость вдоха усугубляет неравномерность альвеолярного распределения газа. Так, по данным Б.П. Максимова (1979), наибольшая неравномерность вентиляции отмечена при ИВЛ с длительностью фазы вдоха, составляющей 15% от времени всего дыхательного цикла (т.е. при отношении длительности вдох/выдох примерно 1:6), и, напротив, равномерность вентиляции была оптимальной, когда длительность фазы вдоха составляла 33% от времени всего дыхательного цикла (т.е. при отношении длительности вдох/выдох как 1:2). Spalding, Smith (1978) наблюдали заметное увеличение функционального мертвого пространства при уменьшении длительности вдоха и, следовательно, увеличении скорости потока газа при ИВЛ у детей. Lachmann и соавт. (1978) экспериментально установили, что при тяжелых поражениях легких наилучшие результаты окснгенации крови при ИВЛ удается получить при отношении длительности вдоха и выдоха, равном 4:1.
При выборе оптимальной величины скорости вдоха существуют две противоположные тенденции: одна — увеличивать скорость вдоха в интересах гемодинамики, другая — уменьшать ее в интересах легочного газообмена. Еще в 1948 г. Cournand и соавт. установили, что оптимальная длительность вдоха в обычных условиях составляет 1 с, а среднефизиологическая скорость — 30 — 50 л/мин. При такой скорости вдоха А.П. Зильбер и соавт. наблюдали оптимальные показатели легочных функций, увеличение же скорости вдоха на 30 — 40% за счет укорочения длительности вдоха приводило к ухудшению газо- и гемодинамики в легких и нарушению легочных функций.
Из изложенного выше можно сделать вывод, что диапазон регулирования величины отношения длительности выдоха и вдоха у аппаратов ИВЛ должен иметь границы от 1 до 3, а оптимальной величиной, если этот параметр нерегулируем, следует считать величину, равную 2. Именно такую величину предлагают в числе основных требований к аппаратам ИВЛ Loh, Sykes (1978). Лучшие аппараты ИВЛ (в том числе отечественные) допускают регулировку данного параметра в оптимальных пределах.
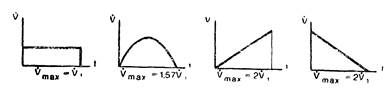
5. Различные формы скорости вдувания, обеспечивающие подачу одного и того же дыхательного объема: слева направо — постоянная, синусоидальная, возрастающая, убывающая, V1 — средняя скорость.
Выше рассмотрено влияние на гемодинамику и газообмен скорости потока газа, когда этот параметр имеет постоянную величину в течение всей фазы вдоха (т.е. когда форма волны вдыхаемого потока имеет характер прямоугольного импульса, как, например, у отечественных аппаратов РО). Однако это лишь частный случай. Аппараты ИВЛ генерируют потоки газа с разными формами графических кривых вдыхаемого потока: нарастающей (так называемой «наклонной», «пилообразной»), как у аппаратов «Энгстрем»; убывающей («отрицательно-наклонной», «обратной пилообразной» и т.п. различных авторов), как, например, у аппарата «Барнет-вентилятор»; синусоидальной, как, например, у аппарата «Спиромат-650» (рис. 5).
Herzog, Norlander (1968) — создатели аппарата «Энгстрем» — высказали мнение, что оптимальные результаты для легочного газообмена при ИВЛ можно получить при нарастающей скорости вдыхаемого потока, свойственной этому аппарату. Наиболее интенсивные исследования в этом направлении были проведены в 70-е годы, когда появились аппараты ИВЛ, позволяющие выбирать форму вдыхаемого потока (например, «Сервовентилятор-900», «Ииевмотрон-80»). Однако результаты исследований оказались весьма противоречивыми. Так, Johansson и соавт. (1975) установили, что общее влияние на распределение потока газа в легких и на легочную перфузию у обследуемых лиц (без легочной или сердечно-сосудистой патологии) в случае ИВЛ при нарастающей или постоянной скорости было лучше, чем при убывающей; этот эффект был заметнее при более высокой частоте дыхания и малой паузе в конце вдоха. В легочной механике у больных с хроническими заболеваниями легких, как и у больных без легочной патологии, выявлено некоторое преимущество убывающей скорости вдыхаемого потока газа. Наконец, при исследовании гемодинамических показателей было обнаружено очень малое влияние различных форм скоростей вдыхаемого потока. Авторы объясняют это эффектом «фильтрации» в сложной легочной структуре с участками различных сопротивлений, приводящим к своего рода «демпфированию», смягчению различий волн и к образованию в конечном итоге формы движения газа в легких, близкой к синусоидальной.
Baker и соавт. (1977) нашли, что убывающая скорость потока при ИВЛ наиболее благоприятна для большинства физиологических параметров; применение нарастающей скорости потока приводит к увеличению легочного шунтирования крови; синусоидальная и прямоугольная формы скорости потока, мало различаясь по влиянию на физиологические показатели, занимают промежуточное положение между влиянием убывающей и нарастающей форм скорости потока. В противоположность указанным авторам А.П. Зильбер и соавт. (1977) показали, что при ИВЛ любой длительности наиболее целесообразна нарастающая скорость потока, с «пиком» в конце вдоха.
Можно было бы продолжить противопоставление результатов и мнений различных исследователей. Однако все единодушны в одном: различия во влиянии на основные физиологические показатели разных форм скорости вдыхаемого потока, даже если они существуют, непостоянны и несущественны. Похоже, что возможность регулирования формы скорости вдыхаемого потока больше служит «престижности» аппаратов и отражает желание быстрее реализовать технические новшества, а не удовлетворить объективные медицинские потребности.
Во время ИВЛ (особенно длительной) врач всегда стремится найти, хотя бы эмпирически, оптимальные параметры вентиляции. В связи с этим целесообразно, чтобы современный универсальный аппарат ИВЛ дал возможность врачу выбрать оптимальную для данного больного форму скорости вдыхаемого потока.
3. Выдох должен осуществляться без сопротивления, т.е. после окончания вдоха должно обеспечиваться свободное и быстрое падение давления в системе аппарат — легкие до уровня атмосферного.
В современных аппаратах ИВЛ предусматривается возможность выпуска выдыхаемого газа через клапан, обладающий минимальным сопротивлением. В лучших моделях это сопротивление не превышает 0,6 см вод.ст.
Исключение составляют случаи, когда повышение сопротивления выдоху, создающее положительное давление в конце выдоха (ПДКВ, PEEP), имеет терапевтические цели. Ряд клинических и экспериментальных исследований показал, что ИВЛ с перемежающимся положительно-положительным давлением (т.е. с ПДКВ), сопровождающаяся увеличением функциональной остаточной емкости легких, улучшает вентиляционно-перфузионные соотношения и уменьшает венозное шунтирование [Кассиль В.Л. и др., 1975; Perel et al., 1978]. Положительное давление в конце выдоха уменьшает эффект преждевременного экспираторного закрытия дыхательных путей, поддерживает проходимость воздухоносных путей, препятствует спадению альвеол и образованию ателектазов [Ashbaugh, 1973].
Говоря о положительном влиянии ИВЛ с ПДКВ, нельзя игнорировать отрицательные эффекты способа, связанные с повышением внутрилегочного давления.
Johansson и соавт. (1972) установили, что ИВЛ с ПДКВ приводит к снижению общего кровотока на 26% и повышению давления в системе воротной вены. Hedenstierna и соавт. (1979) при ПДКВ, равном 20 см вод.ст., отмечали снижение легочного кровотока в 2 — 3 раза с выраженными нарушениями равномерности его распределения (смещение кровотока от центра легких к периферии). Fewell и соавт. (1980) при ИВЛ с ПДКВ обнаружили уменьшению давления в системе воротной вены. Hedenstierna объемов правого и левого желудочков и снижение сердечного выброса за счет уменьшения венозного возврата крови.
И все же способ ИВЛ с ПДКВ остается показанным при некоторых клинических ситуациях, например, как считают В.Л. Кассиль и Н.М. Рябова (1977), у больных с ухудшением механических свойств легких, с нарушением вентиляционно-перфузионных отношений и с увеличенным венозным шунтнрованием, когда вдыхание гипероксической смеси не в состоянии корригировать гнпоксемию. Bergmann и Necek, делая программный доклад на VII Конгрессе анестезиологов и реаниматологов ГДР (1978), также рекомендовали этот способ в ряде случаев при условии регулирования давления в конце вдоха в зависимости от величины легочного шунтнровання, статической растяжимости легких и Рао2.
В совместном докладе Kuckelt и соавт., Г.А. Петракова и В.Л. Кассиля на упомянутом конгрессе было показано, что величины ПДКВ (от 5 до 20 см вод.ст.) должны применяться при ИВЛ в зависимости от оптимизации статической тораколегочной растяжимости; при этом сделан вывод, что ПДКВ выше 20 см вод.ст., не оказывая положительного влияния на растяжимость легких, ухудшает гемодинамику и нарушает транспорт кислорода.
При тяжелых формах респираторного дистресс-синдрома (например, при геморрагической гриппозной пневмонии) мы предлагаем применять ИВЛ с так называемым оптимальным ПДКВ.
Суть метода заключается в следующем. Известно, что величины легочного шунта, не превосходящие 15%, являются достаточно удовлетворительными. Расчеты показывают, что если при вдыхании 100% О2 величина Рао2 достигает 400 мм рт. ст., величина легочного шунта составляет примерно 15%. Следовательно, задача состоит в том, чтобы найти такой режим ИВЛ, при котором величина Рао2 у больного составляла бы примерно 400 мм рт. ст. при вентиляции 100% кислородом, а затем, учитывая отрицательные эффекты длительной ингаляции гипероксических смесей, уменьшить концентрацию O2 до приемлемых величин (40 — 50%).
В условиях полной адаптации больного к аппарату ИВЛ при подаче 100% кислорода начинают постепенно повышать давление конца выдоха, увеличивая его каждый раз на 5 см вод.ст. Через 20 мин после очередного повышения исследуют Pao2 и Расо2, полагая, что указанное время достаточно для установления нового уровня газов крови под влиянием измененного режима ИВЛ. Если Рао2 не достигает 400 мм рт. ст., то производят очередное повышение ПДКВ, показатель же Расо2 служит основанием для коррекции вентиляционных объемов. Таким образом, интервалы времени между каждым повышением ПДКВ составляют приблизительно 30 мин. Одновременно тщательно наблюдают за состоянием артериального и центрального венозного давлений, регулируя на этой основе темп внутривенных инфузий плазмозамещающих растворов и вазопрессорных средств.
Существует несколько способов создания ПДКВ. Один из способов состоит в увеличении сопротивления выдоху с помощью специального крана в линии выдоха аппарата. Такой кран входит в состав ряда отечественных аппаратов ИВЛ. При другом способе используется выдох с пре одолением давления, создаваемого специальными клапанами или погружением конца шланга выдоха в воду на определенную глубину. Можно заметить, что при включении сопротивления выдоху (рис. 6, г) объемная скорость выдоха уменьшается (сравните с рис. 6, а), а время динамической фазы выдоха увеличивается, паузы после выдоха нет; если увеличить продолжительность фазы выдоха, то можно снизить давление в конце выдоха до нуля. При втором способе — включении противодавления — кривая объемной скорости (рис. 6,в) сохраняет приблизительно такой же вид, как при вентиляции с перемежающимся положительно-нулевым давлением, по основание кривой давления смещено по осп ординат на величину ПДКВ. Сравнительные преимущества способов ПДКВ пока еще недостаточно обоснованы. Однако включение противодавления чаще используют при преобладающих расстройствах легочной диффузии («шоковое легкое», «респираторные дистресс-синдромы»), а увеличение сопротивления выдоху применяют для уменьшения преждевременного экспираторного закрытия дыхательных путей при обструктивных синдромах.
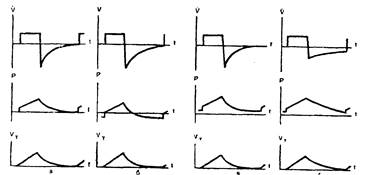
6. Функциональные кривые при ИВЛ с пассивным выдохом (а), с активным выдохом (б), с положительным давлением в конце выдоха, полученным с помощью клапана ПДКВ (в) и крапа сопротивления выдоху (г).
V — объемная скорость; Р — давление на выходе аппарата; VT — дыхательный объем.
К способу ИВЛ с ПДКВ (особенно при «сеансном» применении ПДКВ) примыкает способ периодического раздувания легких (так называемые искусственные глубокие вздохи). Мнение о том, что нормальное дыхание есть дыхание равномерное, со стабильной глубиной вдохов, было опровергнуто работами Mead, Collier (1959), а также Egbert и соавт. (1965) и Ferns, Pollard (1966).
Уменьшение растяжимости легких при «монотонной» вентиляции с современных позиций можно объяснить прогрессирующим коллабированием «работающих» альвеол из-за расходования в них сурфактантов. Для раскрытия резервных альвеол, в которых происходило накопление сурфактантов, необходимо дополнительное дыхательное усилие — гиперинфляция, сопровождающаяся увеличением функциональной остаточной емкости легких. Периодическая гиперинфляция — обязательный компонент нормального дыхания человека.
В современных моделях аппаратов ИВЛ периодическая гиперинфляция достигается разными способами. Так, в аппарате «Энгстрем ЕКС-2000» используется режим глубоких вздохов, при котором на каждые 100 или 400 обычных вдохов приходится 2 вдоха двойного объема. Однако такой способ не может считаться оптимальным. Анестезиологи, которые принимали участие в операциях на открытой грудной клетке, знают, что хорошее расправление легкого может быть достигнуто при вентиляции вручную не просто увеличением дыхательного объема, а препятствием расправлению дыхательного мешка на выдохе, т.е. созданием ПДКВ. Garrard, Shah (1978) считают, что положительное давление на выдохе является простым и эффективным методом увеличения функциональной остаточной емкости при временном и обратимом снижении объема легких.
В аппарате «Спиромат-661» способ раздувания легких обеспечивается регулируемым увеличением давления выдоха один раз на каждые 100 вдохов в течение 3 дыхательных циклов. В аппарате «Спиромат-760» периоды раздувания повторяются чаще — через каждые 50 вдохов. В отечественных аппаратах РО-5 и РО-6 имеется система автоматического раздувания, которая через каждые 8 мин на 2 — 3 дыхательных цикла включает сопротивление выдоху, что вызывает нарастающую задержку в легких дыхательного газа и кратковременное увеличение функциональной остаточной емкости легких. Это приводит к кратковременному возрастанию давления в конце выдоха и конце вдоха на 8 — 10 см вод.ст.
4. В фазе выдоха может быть применено отрицательное давление. Снижение среднего внутрилегочного давления до нуля, а при необходимости получение отрицательного давления можно обеспечить разрежением при выдохе, т.е. полным или частичным принудительным отсасыванием газа во время выдоха (так называемый активный выдох, или вентиляция с перемежающимся положительно-отрицательным давлением, ВППОД, NEEP).
Целесообразность отрицательного давления на выдохе дискутируется еще со времени так называемого пульмоторного диспута: в 20-е годы крупный американский физиолог Гендерсон возразил против использования в немецком аппарате «Пульмотор» фазы отрицательного давления. Однако многие клиницисты и физиологи высказались в пользу активного выдоха [Неговский В.А., Гаевская М.С., 1956; Steiner et al., 1965; Lissac et al., 1977].
Применение отрицательного давления на выдохе снижает среднее внутрилегочное давление в результате того, что: а) вдох начинается при давлении в легких ниже атмосферного, и поэтому альвеолярный «пик давления» ниже, чем если бы вдох с тем же дыхательным объемом был начат при атмосферном давлении; б) появляется пик отрицательного давления на выдохе. Среднее отрицательное внутрилегочное давление суммируется со средним положительным внутрилегочным давлением, вследствие чего значительно уменьшается абсолютная величина последнего (см. рис. 6,6). По мнению Frey, Stoffregen, наиболее благоприятным результатом суммирования будет такой, когда среднее внутрилегочное давление станет равным нулю; скорость выдоха можно увеличить применением отрицательного давления, что существенно в случаях повышенного сопротивления выдоху.
Кроме уменьшения среднего внутрилегочного давления, фаза отрицательного давления на выдохе непосредственно способствует увеличению венозного возврата, как бы восстанавливая присасывающий эффект «грудной помпы», свойственный спонтанному дыханию. Hubay и соавт. (1955) обнаружили увеличение венозного возврата на 33% при нормоволемии и на 100% при гиповолемии. Пик отрицательного давления не должен быть слишком большим.
Вполне достаточно, чтобы он составлял 1/3 — 1/2 — величины пика положительного давления, т.е. в среднем 5 — 7 см вод.ст.
При некоторых заболеваниях легких, сопровождающихся потерей эластических свойств бронхов (деструктивный бронхит, диффузный пневмосклероз, обструктивная эмфизема легких), применять отрицательное давление на выдохе нужно чрезвычайно осторожно. При этих заболеваниях стенки бронхов малого калибра становятся дряблыми и, следуя закону Бернулли, в ответ на высокое разрежение «во рту» легко спадаются, давая хорошо известный симптом «воздушной ловушки» («Cheak-valve» английских авторов) и увеличивая эффект экспираторного закрытия дыхательных путей (ЭЗДП).
Не следует считать, что отрицательное давление на выдохе улучшает легочный газообмен. Наши исследования показали, что введение отрицательного давления в фазу выдоха не увеличивает элиминацию углекислого газа. Более того, оно оказывает неблагоприятное влияние на равномерность распределения вентиляции, о чем свидетельствует патологический характер капнографической кривой (отсутствие альвеолярного «плато», а также удлинение времени денитрогенации, обнаруженное нами при азотографии. Sykes и соавт. (1970) установили, что разрежение на выдохе — 10 см вод.ст. сопровождалось резким увеличением венозной примеси (до 26% минутного объема сердца). Они объяснили это увеличением внутрилегочного объема крови на высоте выдоха, когда вентиляционный объем легких наименьший, а также отеком под действием градиента давлений по обе стороны альвеоло-капиллярной мембраны и коллапсом альвеол. Мы разделяем мнение В.Л. Кассиля и Н.М. Рябовой (1977), а также А.П. Зильбера (1978), что при ряде заболеваний (пневмония, ателектаз, отек легких, обструктивные легочные заболевания» переломы ребер) следует отказаться от применения активного выдоха. В то же время, как показал наш опыт, а также опыт других исследователей [Уваров Б.С. и др., 1965; Чепкий Л.П. и др., 1967], активный выдох целесообразен при заболеваниях, сопровождающихся тяжелыми расстройствами кровообращения.
Измерение давления и разрежения в системе аппарат — больной не представляет трудностей. Нужно, однако, помнить, что показания измерительных приборов аппаратов ИВЛ представляют собой величину давления «во рту», которая часто отличается от величины давления в легких. Разница тем больше, чем выше сопротивление дыхательных путей.
Описанное выше представляет собой в основном общий подход к рациональному выбору параметров ИВЛ. Ряд конкретных вопросов методики и выбора этих параметров следует решать индивидуально у каждого больного, сообразно характеру его дыхательной и прочей патологии.
Дата добавления: 2015-03-09; просмотров: 3713;
